
科目: 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_________。和O同一周期且元素的第一电离能比O大的有______(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)H2O分子中O原子的价层电子对数是________,CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为_______。
(3)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为_________,原因是__________。
(4)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(5)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
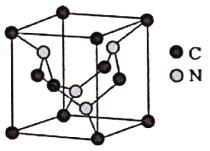
①该晶体硬度超过金刚石的原因是____________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为了回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡,烧杯内剩余固体27g,求反应中产生气体的质量。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用富含纤维素的木屑在较浓硫酸的作用下,膨胀、水解,生成葡萄糖;酸性条件下,葡萄糖与阳极泥中的二氧化锰反应生成可溶性的硫酸锰。

回答下列问题:
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为__________。
(2)配平“浸出”步骤中发生反应的化学方程式:C6 H12O6+_____MnO2+_____H2SO4=____MnSO4+____CO2↑+____H2O,_____________________
(3)若取消“除酸”操作步骤,将会产生______气体(写化学式)而污染环境。
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式:__________。
(5)取一定量的阳极泥进行实验分析,得到如右图象。硫酸的最合适用量为_____mL,若再增加硫酸的用量,将会导致________。(写化学式)的消耗量增大。

(6)某阳极泥中MnO2的质量分数为50.0%,将174 g该阳极泥与320 g浓盐酸(溶质质量分数为36.5%)混合加热,则产生的氯气在标准状况下应少于_____L(精确到0.1,假设阳极泥中的其他成分不参与反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,lmolX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
A. 达到平衡时,3v正(Y)=2v逆(Z)
B. 反应一段时间后,X与Y的转化率之比为1:3
C. X的体积分数不变,说明反应己达到平衡状态
D. 达到平衡后,若从平衡体系中移走部分的Z则v正增大v逆减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目: 来源: 题型:
【题目】醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
A. CH3OH的标准燃烧热为△H=192.9kJ·mol-1
B. 反应①中的能量变化如图所示

C. 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ/mol
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下面化学键键能数据,判断下列分子中受热时最不稳定的是( )
化学键 | H-H | H-F | H-Br | H-I |
键能(kJ/mol) | 436 | 565 | 368 | 297 |
A.氢气B.氟化氢C.溴化氢D.碘化氢
查看答案和解析>>
科目: 来源: 题型:
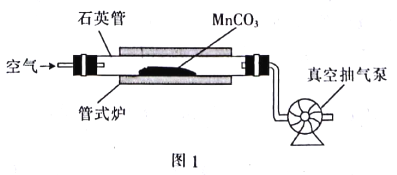
【题目】MnO2可作氧化剂、催化剂和干电池中的去极化剂,通过图1装置焙烧MrCO3可以制取MnO2。
已知:2MnO(s)+O2(g)=2MnO2(s) △H1=a kJ.mol-l
MnCO3 (s)=MnO(s)+CO2 (g) △H2=b kJ.mol-l
回答下列问题:
(1)写出图1装置中制取MnO2的热化学方程式:__________(△H用含a、b的代数式表示)。
(2)一定条件下,在1L恒容密闭容器中,该反应达到化学平衡时,CO2与O2的物质的量之比为m,氧气的物质的量为2 mol,则化学平衡常数K=__________。
(3)用真空抽气泵不断抽气的目的是___________(从化学平衡的角度回答)。
(4)某科研小组对碳酸锰与空气反应制备二氧化锰的条件(焙烧温度和气氛)进行了研究,获得三幅图(如图所示)。

①制备时焙烧温度为________,气氛条件为________。
②图2中是在常压(0.1 MPa)下获得的数据,试在图2中用虚线画出10 MPa下反应温度与转化率的关系图。__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)实验前要首先进行的操作是____________.
(2)现象Ⅰ中白雾的成分是_________(填名称),形成白雾的原因是________.
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______.
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象:B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com