
科目: 来源: 题型:
若某共价化合物分子中含有C、N、H三种元素,且以n(C)、n(N)分别表示C、N的原子数目,则H原子数目最多等于( )
A.2n(C)+2+n(N) B.2n(C)+2+2n(N)
C.3n+2 D.2n(C)+2n(N)+1
查看答案和解析>>
科目: 来源: 题型:
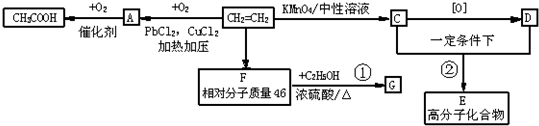
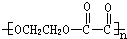
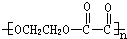
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

| 1 |
| V |
| 1 |
| V |
查看答案和解析>>
科目: 来源: 题型:
 (1)得到的澄清溶液名称为
(1)得到的澄清溶液名称为查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |

查看答案和解析>>
科目: 来源: 题型:
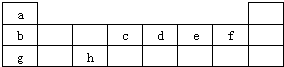 (2010?普陀区二模)如图是元素周期表的前三周期.请用相应的化学用语回答下列问题:
(2010?普陀区二模)如图是元素周期表的前三周期.请用相应的化学用语回答下列问题:


查看答案和解析>>
科目: 来源: 题型:
n- 4 |
| O | n- 4 |
n- 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2010?普陀区二模)
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com