
科目: 来源: 题型:
【题目】Na2O2可用作制氧剂、漂白剂。
(1)已知:2CrO42ˉ+2H+![]() Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
(2)某化学兴趣小组同学欲在实验室中制备少量Na2O2。
查阅资料得知,将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453—473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573—673K,即可制得Na2O2。
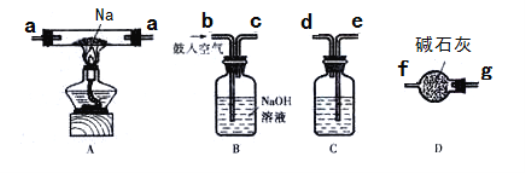
①若采用上述仪器装置制备Na2O2,从左到右仪器的连接顺序为(填接口字母,各装置只能用一次)________;装置D的作用为________。
②装置A中生成Na2O2的化学反应方程式为_______________________。
③若实验时准确称取2.3 gNa进行反应,将反应后的固体溶于1L水中,向所得溶液中加入50 mL 0.5 mol/L NH4Al(SO4)2溶液充分反应,请写出加入NH4A1(SO4)2溶液后发生反应的离子方程式________。
(3)小组同学继续对反应后固体的组成进行探究。
a.取一定量反应后固体,加入足量水充分反应,有气体生成;
b.将生成的气体全部转入真空密闭容器中,放电后充分反应,气体体积减少了3 / 5(不考虑O3的生成)。
①反应后固体中一定有的物质为________(填化学式)。
②为进一步确定反应后固体的组成,需对b中剩余气体继续进行猜想与设计,请完成下表。
猜想 | 实验设计 | 现象与结论 |
剩余气体为___________。 | _______________________________。 | 若看到____________ 证明此猜想正确,反之则不正确 |
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
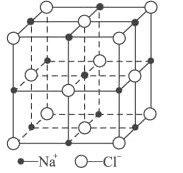
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图所示:
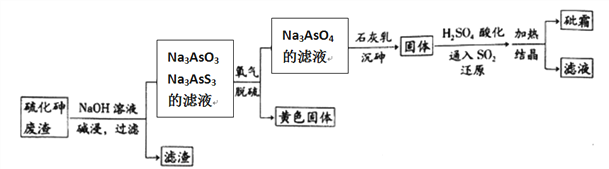
(1)硫化砷中砷元素化合价为__________,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为________________________。
(2)氧化脱硫过程中被氧化的元素是____________。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是____________________。
(4)“沉砷”是在一定温度下将砷元素转化为Ca5(AsO4)3OH沉淀的过程,主要反应有:
a.Ca(OH)2(S)![]() Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S)![]() 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
加入石灰乳调溶液中c(OH-) =0.01mol L-1,此时溶液中c(AsO43-) =________________。(已知: ![]() =2. 15)
=2. 15)
(5)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
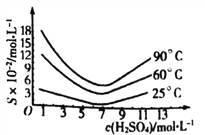
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_________________。
(6)在工业生产中,最后一步所得滤液可循环使用,其目的是____________________。
(7)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式___________________________________________。
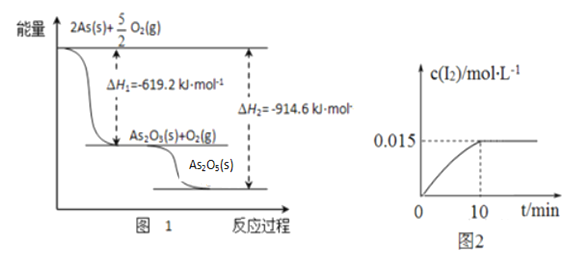
②砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d. ![]() 保持不再变化
保持不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A. 原子半径:W>Z>Y>X>M
B. 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C. 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D. CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
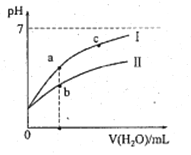
弱酸的电离平衡常数(25℃) | |
CH3COOH | HClO |
Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com