
科目: 来源: 题型:
| 代号 | 物质 | 结构式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 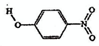 |
1.7 | 114 | 295 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:




 (用反应流程图表示,并注明反应条件).
(用反应流程图表示,并注明反应条件).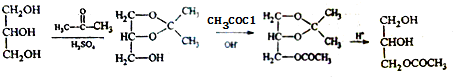
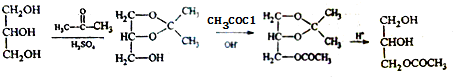

查看答案和解析>>
科目: 来源: 题型:
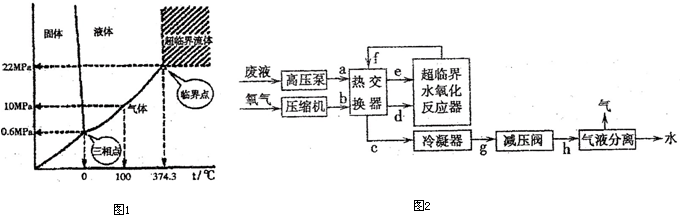
查看答案和解析>>
科目: 来源: 题型:阅读理解
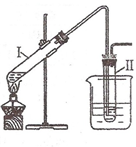 (2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.
(2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.| △ |
| △ |
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. |
液体分层,上层可能含有NaOH及NaBr. 液体分层,上层可能含有NaOH及NaBr. |
| 2 | 取上层清夜于小试管中,加入过量的稀硝酸酸化. 取上层清夜于小试管中,加入过量的稀硝酸酸化. |
无明显现象. 无明显现象. |
| 3 | 取少许酸化后的溶液用pH试纸检验. 取少许酸化后的溶液用pH试纸检验. |
pH试纸呈红色,溶液呈酸性. pH试纸呈红色,溶液呈酸性. |
| 4 | 向上述酸化的溶液中滴加AgNO3溶液. 向上述酸化的溶液中滴加AgNO3溶液. |
有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com