
科目: 来源: 题型:
【题目】KMnO4是实验室常用的氧化剂,可用作水处理剂等。
(1)实验室用MnO2等为原料制取少量KMnO4的实验流程如下:

①“熔融”时,可用作坩埚材质的是__________ (填序号)。
a.氧化铝 b.陶瓷 c.铁 d.玻璃
②“K2MnO4歧化”的离子方程式为__________。
③“蒸发浓缩”时,温度需控制在80℃,适宜的加热方式是__________。
(2)高锰酸钾法测定水体COD(化学雷氧量)的实验步骤如下:
步骤1.准确移取100mL水样,置于250mL锥形瓶中。加入10mL1∶3的硫酸,再加入15.00mL0.0200mol·L-1KMnO4溶液(此时溶液仍呈紫红色)。
步骤2.用小火煮沸10min(水中还原性物质被MnO4-氧化,本身还原为Mn2+),取下锥形瓶趁热加10.00mL0.0500mol·L-1Na2C2O4溶液,充分振荡(此时溶液为无色)。
步骤3.趁热用0.0200 mol·L-1KMnO4溶液滴定至呈微红色,消耗KMnO4溶液4.500mL。通过计算确定该水样的化学需氧量(写出计算过程)。__________________[已知:COD是指在一定条件下,以氧化1L水样中还原性物质所消耗的氧化剂的量,通常换算为需要的O2的质量(mg),COD的单位mg·L-1。]
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
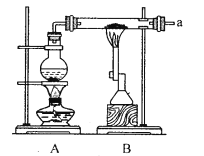
(1)铁粉与水蒸气反应的化学方程式为______;烧瓶中加入沸石的目的是_______
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a![]() _______。
_______。
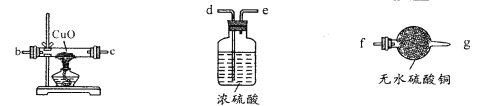
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______;
步骤二:取过滤后所得固体加入过量_______,过滤;
步骤三:___________。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚磷酸(H3PO3)是一种二元弱酸,向某依度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
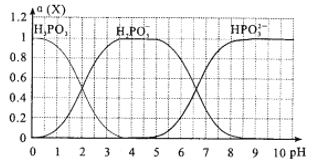
(1)以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_____________
(2)H3PO3的第一步电离H3PO3![]() H2PO3-+H+的电离平衡常数为Ka1,则pKa1=_______ (pKa1=-lgKa1)。
H2PO3-+H+的电离平衡常数为Ka1,则pKa1=_______ (pKa1=-lgKa1)。
(3)将0.lmol/L的NaOH逐滴滴入0.1mo/L的亚磷酸,为了主要得到Na2HPO3,反应应控制pH至少为_______;当反应至溶液呈中性时,c(Na+)______c(H2PO3-)+ 2c(HPO32-)(填“>”、“<”或“一”)。
(4)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:

(1)C中含氧官能团名称为__________和__________。
(2)D生成E的反应类型为__________。
(3)化合物X的分子式为C9H8O2,写出X的结构简式:__________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
能发生水解反应,两种水解产物均能与FeCl3溶液发生显色反应且分子中均只有4种不同化学环境的氢。
(5)已知:R1-CHO![]()
![]() (R1、R2代表烃基或H)
(R1、R2代表烃基或H)
请写出以![]() 、CH3CHO和(CH3)2SO4为原料制备
、CH3CHO和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
(1)“溶解浸取”时,下列措施不能提高铜的浸取率的是__________(填序号)。
a.将海绵铜粉末与水搅拌成浆液 b.投料时,NaNO3适当过量
c.缩短浸取时间 d.将滤渣1返回再次溶解浸取
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图-1、图-2所示:
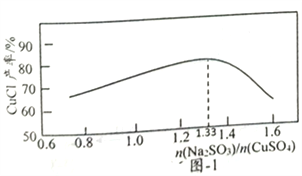

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离了方程式为__________。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是__________。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是__________。
(3)“过滤2”所得滤液中溶质的主要成分为__________(填化学式)。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为10 L的密闭容器中充入1mol H2和1mol I2,并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
(1)反应从开始到平衡时,v(H2)为_______,平衡常数K=__________。
(2)温度不变,达到平衡后向容器中再充入1molHI气体,平衡向________ (填“正向”、“逆向”或“不移动”)移动;再次平衡后,HI的体积分数将________ (填“增大”、“减小”或“不变”)
(3)将(2)所得平衡体系升温,平衡后I2的体积分数为45%,则升温后,H2的转化率将_____(填“增大”、“减小”或“不 变”),该反应的ΔH_____0(填“>”、“ <”或“=”)。
(4)结合(3)请画出2HI(g)![]() H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
 _____
_____
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(81Tl)是重要成分之,已知铊和铝是同主族元素,关于铊的性质推断错误的是
A.铊是银白色,质软的金属
B.铊不能形成稳定的气态氢化物
C.铊与浓硫酸反应生成T12(SO4)3
D.Tl(OH)3是两性氢氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)![]() (CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
(CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |

下列说法正确的是( )
A. 该反应的△H<0,图中压强p1>p2
B. 达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C. 达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D. 达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
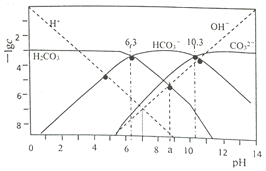
A. pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1
B. pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-)
C. pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-)
D. 25℃时,反应H2CO3+CO32-![]() 2HCO3-的平衡常数为1.0×104
2HCO3-的平衡常数为1.0×104
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com