
科目: 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。

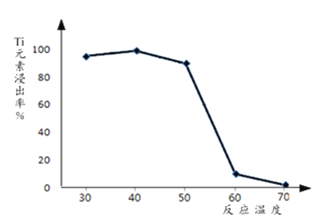
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A.鉴别氢氧化铝胶体(无色)和食盐水,可以不用任何试剂
B.鉴别白糖水和食盐溶液,可以不用任何试剂
C.鉴别粉笔末与水、豆油与水组成的浊液,可以不用任何试剂
D.鉴别氯化钠溶液与硫酸铜两种溶液,可以不用任何试剂
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧有强氧化性能在一定条件下将烟气中的SO2、NOx分别氧化为SO42- 和NO3 -。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)NO3-中心原子轨道的杂化类型为___________;SO42- 的空间构型为_____________(用文字描述)。
(2)Fe3+基态核外外层电子排布式为__________________。
(3)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步: OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为_______。
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O3溶液进行滴定恰好到达终点。
(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①O3与KI溶液反应生成两种单质,则反应的化学方程式__________________________。
②该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
③该实验中可选用_______(填物质名称)作指示剂。空气中臭氧的体积分数为_______。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.7 g铝放入足量氢氧化钠溶液中完全反应后,在标准状况下,生成气体的体积是( )
A.1.12 LB.2.24 LC.3.36 LD.4.48 L
查看答案和解析>>
科目: 来源: 题型:
【题目】在离子RO3n-中共有x个核外电子,R原子的质量数A,则R原子核内含有的中子数是( )
A.A-x+n+48B.A-x-n-24C.A-x+n+24D.A+x-n-24
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,投入0.2mol N2和0.6 mol H2 ,发生可逆反应N2(g)+3H2(g)![]() 2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
A. 2min内H2的反应速率为0.01mol·L-1·min-1
B. 若2min后,往容器中通入0.2mol的氩气,则生成NH3的反应速率加快
C. 若混合气体的密度不再改变,则反应达到平衡状态
D. 若单位时间内有3 mol H-H键断裂,同时就有6 mol N-H键断裂,则反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QKJ,在1L的密闭容器中进行反应 2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
A. 反应达到平衡时放出的热量为0.1QKJ
B. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
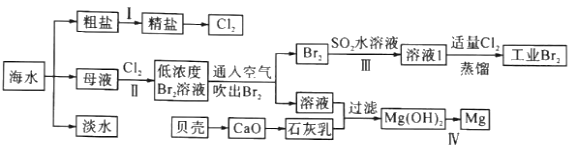
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2需要消耗_________molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C. ![]() D.
D. ![]()
(5)判断Mg(OH)2是否洗涤干净的操作是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关,乙烯的产量通常用来衡量一个国家的石油化工水平。根据下面转化关系回答下列问题:
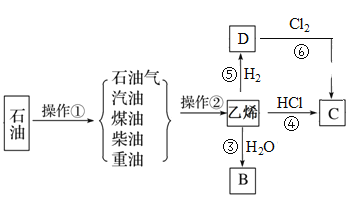
(1)操作①、操作②的名称分别为_____、_____。
(2)乙烯的结构简式为_______。
(3)写出乙烯和水反应生成B的反应③的方程式(注明条件):_____,反应类型为_____。
写出反应⑥的化学方程式(注明条件):_________。
(4)物质C的沸点为12.27 ℃,常用于局部冷冻麻醉应急处理。物质C可通过反应④和反应⑥制得,其中最好的方法是反应____(填“④”或“⑥”),理由为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com