
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
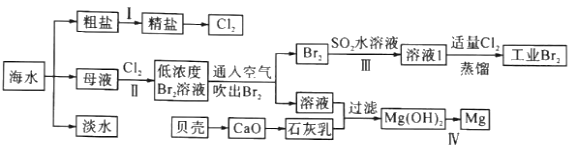
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2需要消耗_________molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C. ![]() D.
D. ![]()
(5)判断Mg(OH)2是否洗涤干净的操作是________________________________________。
【答案】Ca2++CO32-=CaCO3↓ Ba2++ CO32-=BaCO3↓2抑制氯气和水反应Br2+SO32-+H2O=SO42-+2H++2Br-NaBr(或溴化钠)D取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
【解析】
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,可依次加入过量BaCl2(除去硫酸根离子)、Na2CO3(除去钙离子的多余的钡离子)、NaOH(除去镁离子),最后加适量盐酸调节溶液的pH等于7后蒸发即可,所以加入Na2CO3溶液后相关化学反应的离子方程式为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓。
(2)流程中海水提溴,先向母液中通入Cl2将Br-氧化为Br2,再用SO2将其还原为Br-,最后再通入Cl2将Br-氧化为Br2,所以制得1molBr2需要消耗2molCl2。因为氯气和水能发生反应,所以步骤Ⅱ中需要向母液中加入稀硫酸酸化,抑制氯气和水的反应。步骤Ⅱ若用Na2SO3水溶液吸收Br2,SO32-被氧化成SO42-,Br2被还原为Br-,反应的离子方程式为:Br2+SO32-+H2O=SO42-+2H++2Br-。
(3)因为氯气与溴化钠反应生成溴和氯化钠,除去Br2中残留的少量Cl2,可向其中加入NaBr(或溴化钠)溶液。
(4)电解MgCl2溶液得不到单质Mg,氧化镁熔点很高,应电解熔融的MgCl2制取单质Mg,所以D项制取单质镁的方法最合适。
(5)判断Mg(OH)2是否洗涤干净,就是检验最后一次洗涤液中是否存在Cl-,具体操作为:取最后一次洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明Mg(OH)2已经洗涤干净。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯H是一种具有菠萝香味的赋香剂其合成路线如下:


(1)生成A的反应类型为________________,A中所含官能团的结构式是____________。
(2)B的结构简式是______________,G的某同分异构体只有一种相同化学环境的氢,该同分异构体的结构简式为__________________。
(3)写出F和G反应生成H的化学方程式___________________________。
(4)结合题给信息,以乙烯、环氧乙烷和1,3-丁二烯为原料制备 ,设计合成路线(其他试剂任选)。______________________________________________________
,设计合成路线(其他试剂任选)。______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物V L(标准状况),溶于m g 水中,得到质量分数为 w、物质的量浓度为c mol/L、密度为ρg/mL 的溶液,下列说法正确的是
A. 溶液密度ρ=cw/1000M B. 物质的量浓度c=ρV/(MV+22.4m)
C. 溶液的质量分数w=MV/22.4m D. 对分子质量M=22.4mw/(1—w)V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧有强氧化性能在一定条件下将烟气中的SO2、NOx分别氧化为SO42- 和NO3 -。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)NO3-中心原子轨道的杂化类型为___________;SO42- 的空间构型为_____________(用文字描述)。
(2)Fe3+基态核外外层电子排布式为__________________。
(3)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步: OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为_______。
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O3溶液进行滴定恰好到达终点。
(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①O3与KI溶液反应生成两种单质,则反应的化学方程式__________________________。
②该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
③该实验中可选用_______(填物质名称)作指示剂。空气中臭氧的体积分数为_______。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是
![]()
A.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子的物质的量为8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日三名化学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。下列说法正确的是( )
A.有机物中一定含有碳和氢两种元素
B.一定条件下,使用催化剂能提高反应物的平衡转化率
C.将有机物进行“缝合”可以不遵循原子守恒规律
D.将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com