
【题目】美日三名化学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。下列说法正确的是( )
A.有机物中一定含有碳和氢两种元素
B.一定条件下,使用催化剂能提高反应物的平衡转化率
C.将有机物进行“缝合”可以不遵循原子守恒规律
D.将有机物进行“裁剪”需要破坏旧的化学键
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
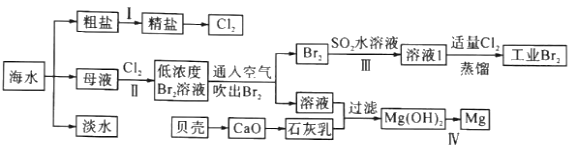
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2需要消耗_________molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C. ![]() D.
D. ![]()
(5)判断Mg(OH)2是否洗涤干净的操作是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学将等体积的甲烷与氯气混合于一试管中,倒扣在盛饱和食盐水的水槽里,然后置于光亮处。一段时间后的现象正确的是:_____;
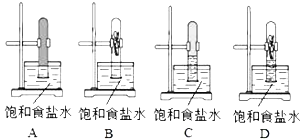
(2)反应后试管中所得有机产物化学式为______________;(有几种写几种)
(3)写出甲烷与氯气反应第一步的化学方程式_________;
(4)在同温同压下,甲烷的同系物A的蒸汽密度是甲烷密度的4.5倍,其分子式__;
(5)A有____种同分异构体;写出其有三个甲基的同分异构体的结构简式___;
(6)A的某同分异构体只有一种一氯代物,请用系统命名法为该同分异构体命名_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假如你是某化工厂的总工程师,为了加快化学反应速率进而提高经济效益,你应优先考虑的措施是
A.选用适宜的催化剂B.采用高压
C.采用高温D.增大反应物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、M、W的原子序数与其某常见化合价的关系如右图所示,下列关系不正确的是
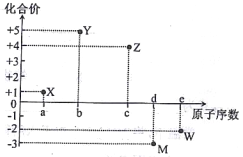
A. 元素X可能为锂
B. 原子半径大小:r(M)>r(w)
C. X2W中各原子均达8电子稳定结构
D. 元素气态氢化物的稳定性:YH3>MH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
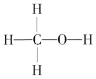
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。
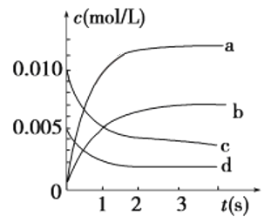
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
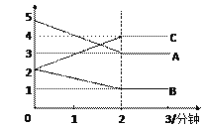
该反应的的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。用电子式表示化合物D2W的形成过程______________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com