
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
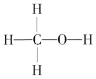
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
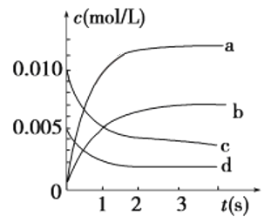
③如下图所示,表示NO2变化曲线的是________。
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
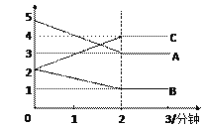
该反应的的化学方程式为________________。
【答案】-175kJ/mol 65% 0.0015 mol/(L.s) b BC 2A+B![]() 2C
2C
【解析】
(1)①拆开3mol H2 (g)和1mol CO2(g)中化学键所吸收的总能量为3×436kJ+2×745 kJ=2798 kJ,形成1mol CH3OH(g) 和1mol H2O(g)所放出的能量是3×412 kJ+351 kJ+3×462kJ=2973 kJ,所以该反应的焓变为2798 kJ/mol -2973 kJ/mol =-175 kJ/mol;
(2) ①到达平衡时NO的转化率为![]() ;
;
②从0~2s内NO平均反应速率为:v(NO)=![]() =0.003molL-1s-1,
=0.003molL-1s-1,
化学反应中反应速率之比等于化学计量数之比,
则v(O2)=![]() v(NO)=
v(NO)=![]() ×0.003molL-1s-1=0.0015molL-1s-1;
×0.003molL-1s-1=0.0015molL-1s-1;
③NO2为生成物,反应中浓度逐渐增大,根据方程式2NO(g)+O2(g)![]() 2NO2(g),可知c(NO2)=c(NO)=2c(O2),
2NO2(g),可知c(NO2)=c(NO)=2c(O2),
则图象中b为NO2的浓度变化曲线,c为NO的浓度变化曲线,d为O2的浓度变化曲线,
故答案为:b;
④A.v(NO2)=2v(O2),没有体现正逆反应速率关系,无法判断是否达到平衡状态,选项A错误;
B.反应2NO(g)+O2(g) ![]() 2NO2(g)为气体体积变化的反应,容器内压强保持不变,说明反应已达平衡状态,选项B正确;
2NO2(g)为气体体积变化的反应,容器内压强保持不变,说明反应已达平衡状态,选项B正确;
C.v逆(NO) =2v逆(O2)=2v正(O2),正逆反应速率相等,说明反应达到平衡状态,选项C正确;
D.反应中气体总质量不变,容器体积不变,故容器内密谋始终保持不变,则容器内的密度保持不变不能说明反应达平衡状态,选项D错误。
答案选BC;
(3)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C。


科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是
![]()
A.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子的物质的量为8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日三名化学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。下列说法正确的是( )
A.有机物中一定含有碳和氢两种元素
B.一定条件下,使用催化剂能提高反应物的平衡转化率
C.将有机物进行“缝合”可以不遵循原子守恒规律
D.将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A. Zn为电池的负极
B. 正极反应式为![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液碱性增大
D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种。
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:____________________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_______________(填化学式)。
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为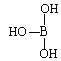 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子_________,三角锥形分子 _________ 。
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为______________________________。
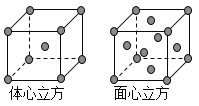
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____________;若两种 晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,正逆反应速率为零
B. 若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜的冶炼方法较早的为人类掌握,人们用铜合金制造各种青铜器,古代的青铜器表面会有铜锈(碱式碳酸铜)生成,其成分可表示为:xCuCO3·yCu(OH)2·zH2O,实验室测定碱式碳酸铜成分的方法有多种。
(1)氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式_________________;
②实验装置用下列仪器连接而成:
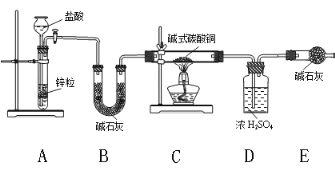
ⅰ、B装置的作用_________,装置中的一个明显缺陷,改进方法是_________________。
ⅱ、称取24 g某碱式碳酸铜样品进行试验,经数据分析处理,反应得到12.8g残留物,4.4g二氧化碳和7.2 g水。该样品中的结晶水质量为__________g,化学式为______________;
(2)某同学认为氢气还原法装置太复杂,提出简化的方法,认为可以只用C、D、E和改进后的装置直接加热碱式碳酸铜分解,你认为是否可行?请说明理由____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com