
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是
![]()
A.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子的物质的量为8 mol
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是
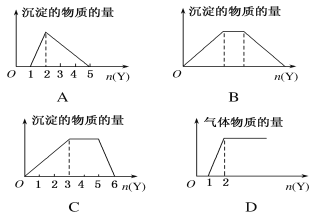
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
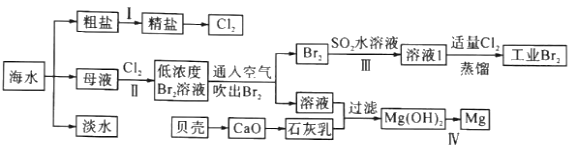
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________。
(2)海水提溴,制得1molBr2需要消耗_________molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C. ![]() D.
D. ![]()
(5)判断Mg(OH)2是否洗涤干净的操作是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某混合物A,含有KAl(SO4)2、Al2O3和Cu2(OH)2CO3,在一定条件下可实现下图所示的物质之间的变化:
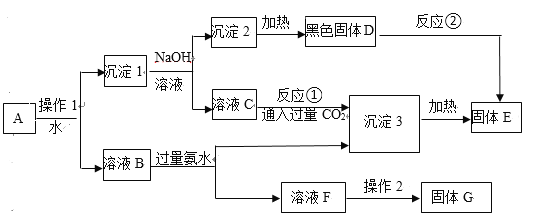
据此判断:
(1)固体G中含有用作化肥的物质,写出其化学式_________。
(2)出土的青铜器上常有铜绿,请写出用稀硫酸除去铜绿的离子方程式_________。
(3)操作1的名称____________; 反应①的离子方程式为____________。
(4)反应②的化学方程式为______________。
II.铝是一种应用广泛的金属,工业上常用冰晶石(Na3AlF6)作助熔剂来冶炼铝。以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
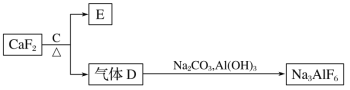
(5)E在医疗上常用作石膏绷带,D的水溶液可用于刻蚀玻璃,C的化学式为_____;并写出由D制备冰晶石的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca2+,则溶液中NO的物质的量浓度为( )
A. 5ρ mol·L-1 B. 2.5ρ mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学将等体积的甲烷与氯气混合于一试管中,倒扣在盛饱和食盐水的水槽里,然后置于光亮处。一段时间后的现象正确的是:_____;
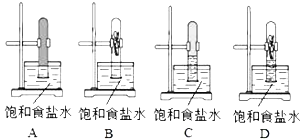
(2)反应后试管中所得有机产物化学式为______________;(有几种写几种)
(3)写出甲烷与氯气反应第一步的化学方程式_________;
(4)在同温同压下,甲烷的同系物A的蒸汽密度是甲烷密度的4.5倍,其分子式__;
(5)A有____种同分异构体;写出其有三个甲基的同分异构体的结构简式___;
(6)A的某同分异构体只有一种一氯代物,请用系统命名法为该同分异构体命名_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
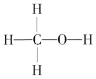
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。
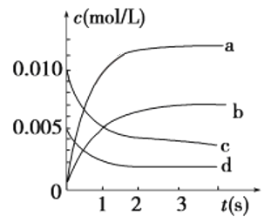
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
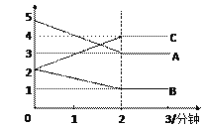
该反应的的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com