
【题目】五种短周期元素X、Y、Z、M、W的原子序数与其某常见化合价的关系如右图所示,下列关系不正确的是
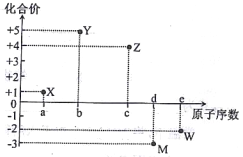
A. 元素X可能为锂
B. 原子半径大小:r(M)>r(w)
C. X2W中各原子均达8电子稳定结构
D. 元素气态氢化物的稳定性:YH3>MH3
【答案】C
【解析】由X的化合价为+1价,属于第IA族元素;Y的化合价为+5价,属于第VA族元素;Z的化合价为+4价,为第IVA族元素;M为的化合价为-3价,属于第VA族元素;W的化合价为-2价,属于第VIA族元素;由图知原子数:X<Y<Z<M<W,Y、M同主族,Y的原子序数小,所以Y为N元素、M为P元素;X的原子序数小于N,则X为H或Li,Z的原子序数大于N,属于第VIA族,则Z为Si元素;W原子序数大于P,则W为S元素;A.由分析可以知道,元素X可能为锂,所以A选项是正确的;B.M为P元素,W为S元素,同周期原子半径从左到右依次减小,则原子半径大小r(M)>r(w),所以B选项是正确的;C.X为H或Li,X2W中X原子不是8电子稳定结构,故C错误;D.元素的非金属性:Y>M,则元素气态氢化物的稳定性: YH3>MH3,所以D选项是正确的.所以C选项是正确的.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】臭氧有强氧化性能在一定条件下将烟气中的SO2、NOx分别氧化为SO42- 和NO3 -。臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)NO3-中心原子轨道的杂化类型为___________;SO42- 的空间构型为_____________(用文字描述)。
(2)Fe3+基态核外外层电子排布式为__________________。
(3)臭氧可用于含CN一碱性电镀废水的处理。第i步:CN一转化为OCN-;第ii步: OCN一继续转化为CO32一及两种单质气体。若第ii步转化时,O3与OCN-物质的质量之比为3∶2,该步反应的离子方程式为_______。
(4)为测定大气中臭氧(O3)含量,将0℃、1.01×105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol/L的Na2S2O3溶液进行滴定恰好到达终点。
(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①O3与KI溶液反应生成两种单质,则反应的化学方程式__________________________。
②该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
③该实验中可选用_______(填物质名称)作指示剂。空气中臭氧的体积分数为_______。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子:阳离子H+、Na+、Al3+、Ag+、Ba2+;则离子OH-、Cl-、CO32-、NO3-、SO42-(各种离子不重复)。已知,①A、B两溶液呈碱性;C、D、E溶液呈酸性。②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。③D溶液与另外四种溶液反应都能产生沉淀。试回答下列问题:
(1)写由A与D的化学式:A___________D___________________。
(2)A与E溶液反应的离子方程式_________________________。
(3)已知:H+(aq)+OH-(aq)=H2O(l)△H=-akJ/mol,请写出相同条件下B与C的稀溶液反应的中和热的热化学方程式_________________________________。
(4)检验E溶液中阴离子的方法为__________________________。
(5)请写出向E溶液中加过量B溶液的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美日三名化学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。下列说法正确的是( )
A.有机物中一定含有碳和氢两种元素
B.一定条件下,使用催化剂能提高反应物的平衡转化率
C.将有机物进行“缝合”可以不遵循原子守恒规律
D.将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science杂志在2017 年报道了世界上首个成功合成的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料里程碑式的突破。该盐结构如图,下列分析不合理的是
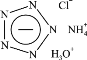
A. 五氮阴离子的化学式为N5—
B. 该盐中阴阳离子数目之比为 ![]()
C. 该盐在碱中比在酸中稳定
D. 该盐存在离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A. Zn为电池的负极
B. 正极反应式为![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液碱性增大
D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请回答下列问题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种。
(2)画出第四周期的第ⅠB族元素基态原子电子排布式:____________________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_______________(填化学式)。
(5)第ⅢA族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为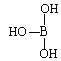 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:_______________________________。
(6)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体分子_________,三角锥形分子 _________ 。
(7)钛被称为未来金属,已知某钛的化合物TiCl3·6H2O(相对分子质量为262.5)配位数为6,取该晶体26.25克配成溶液,加入足量硝酸银溶液,过滤,洗涤,烘干,称重,沉淀为28.70克,则该晶体的化学式可表示为______________________________。
(8)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____________;若两种 晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为____________。
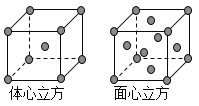
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.lmol某有机物的蒸气跟足量O2混合后点燃,反应后生成13.2 gCO2和5.4gH2O,该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2悬浊液反应生成红色沉淀,则该化合物的结构简式可能是
A. OHC-CH2-CH2COOH B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com