
科目: 来源: 题型:
【题目】铝鞣剂[主要成分为Al(OH)2Cl]主要用于鞣制皮革。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂的一种工艺如图:

回答下列问题:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为____________。“水解”采用90℃而不在室温下进行的原因是_________________ 。
(2)“酸溶”时,Al2O3发生反应的离子方程式为____________________。
(3)“氧化”时,发生反应的离子方程式为________________________。
(4)“除杂”时产生废渣的主要成分为____(填化学式),对其合理的处理方法是回收后制成___。
(5)准确称取所制备的铝鞣剂mg,将其置于足量硝酸中,待样品完全溶解后,加入足量AgNO3溶液,充分反应,过滤、洗涤、干燥得固体ng.则样品中Al(OH)2Cl的质量分数为____(用含m、n的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是______;
②写出溶液中加入过量的稀硫酸反应的离子方程式______;
(2)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为____。
(3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________。
②取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12==2C1O2+2NaCl,装置如下图所示:
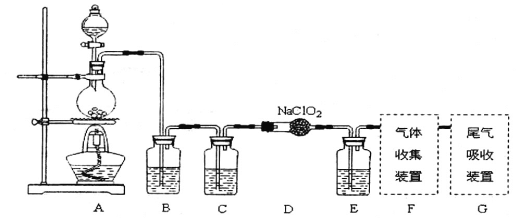
(1)烧瓶内可发生的反应的化学方程式:______________。
(2)B、C、E装置中的试剂依次为____________________
a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水
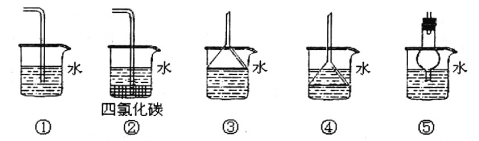
(3)以下装置既能吸收尾气又能防止倒吸的是_____________
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mCL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S2O3溶液滴定(己知:2S2O32-+I2==S4O62-+2I-)。
(4)加入的指示剂是___________,达到滴定终点时的现象是_________;
(5)碘化钾反应的离子方程式是________________。
(6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是___________mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)由A、B两种双原子分子组成的混合气体8.6g,在标准状况下的体积为8.96L,已知A和B的物质的量之比为3∶1,摩尔质量之比为14∶1,则A可能是________(写出两种可能的分子式),B的分子式是_______。
(3)在标准状况下,CO和CO2的混合气体质量36g,体积为22.4L,则CO所占体积是______L,CO的质量是______g。
Ⅱ .标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是_______、_______。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是_______。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_______mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_______g固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气在工农业生产中有重要应用。
(1)氮气用于工业合成氨,写出氮气的电子式 __________;
(2)如下图所示,向NaOH固体上滴少量浓氯化铵溶液,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_________。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是_____(写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH![]() 和____________。
和____________。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,解释其原因____。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为______,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为______ g(小数点后保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
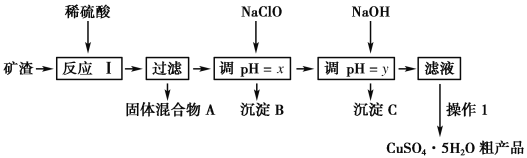
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mLc(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是

A. 原合金质量为0.92g
B. 图中V2为60nL
C. 整个加入盐酸过程中Na+的浓度保持不变
D. Q点m1为1.56g
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是
W(s)+3H2O(g),下列说法不正确的是
A. 增加H2O(g)的量,消耗H2的速率瞬间不变
B. 将容器的体积缩小一半,其反应速率加快
C. 保持体积不变,充入氩气,其反应速率不变
D. 保持压强不变,充入氖气,H2O(g)生成速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com