
科目: 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是 ①单位时间内生成nmolO2,同时生成2nmolNO2;②单位时间内生成nmolO2,同时生成2nmolNO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1;④混合气体的压强不再改变;⑤混合气体的颜色不再改变;⑥混合气体的平均相对分子质量不再改变。
A. ①④⑤⑥ B. ①③④⑥ C. ①②③⑤ D. ②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________________。
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体F的电子式为____________,化合物I中含有的化学键类型有________________。
(4)转化①的离子方程式为_______________________________________________________。
转化⑦的离子方程式为_______________________________________________________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
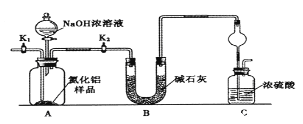
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
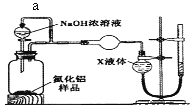
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,能在无色透明的强酸性溶液里大量共存的是
A.MnO4-、K+、Na+、SO42-B.Na+、K+、HCO3-、Cl-
C.Mg2+、NH4+、NO3-、Cl-D.Cu2+、K+、OH-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置为________________。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是______________(填元素符号)。
(3)元素的非金属性Z________Q(填“>”或“<”)。下列各项中,不能说明这一结论的事实有________(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态 D.Z和Q在周期表中的位置
(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出阳离子B的立体构型为__________,离子中键角为_________;X与Q在一定条件下可以形成极不稳定的原子个数比为1:1的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式________________。
(5)M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N在溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
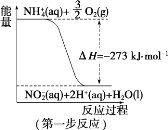

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题:
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为______________。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式_________________。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____________、 _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。

(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.

(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com