
科目: 来源: 题型:
【题目】在一定条件下,制备氯乙烷(C2H5Cl)的方法有:①用乙烷与氯气反应;②用乙烯与氯化氢反应,两种方法中哪一种要更好,写出化学方程式________,该反应的类型是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知断开1molH—H键、1molN≡N、1molN—H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1 molNH3需要_____(填“放出”或“吸收”)____kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() 。下列相关说法不正确的是( )
。下列相关说法不正确的是( )
A. 苹果酸在一定条件下能发生催化氧化反应
B. 1 mol苹果酸与足量NaHCO3溶液反应消耗2 mol NaHCO3
C. 1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)
D. 1 mol苹果酸分别和足量Na或NaOH反应消耗两者物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素分别转化为氢氧化物沉淀而分离开来。
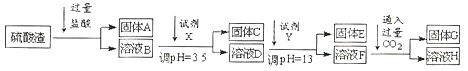
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
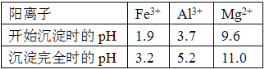
(1)工业上用固体A作原料制取水玻璃的化学方程式为_________。
(2)固体E的化学式为_________。
(3)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______。
(4)上述流程中的试剂Y最好选用下列中的_______(选填字母编号)。
A.水 B.硫酸 C.氨水 D.氢氧化钠
(5)写出反应F→H的离子方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于密闭容器中的反应2SO3(g)![]() O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是( )
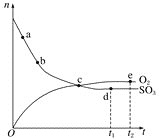
A. 点c处反应达到平衡B. 点b的正反应速率比点a的大
C. 点c的逆反应速率比点e的大D. 点d(t1时刻)和点e(t2时刻)处n(SO2)一样大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数)( )
A. 12 g石墨中含有C—C键的个数为1.5 NA
B. 12 g金刚石中含有C—C键的个数为4 NA
C. 60 g SiO2中含有Si—O键的个数为2 NA
D. 124 g P4中含有P—P键的个数为4 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】光化学烟雾是汽车尾气在紫外线作用下生成的有害浅蓝色烟雾,由氮的氧化物和烃类等一次污染物,与它们发生一系列光化学反应生成的臭氧、醛类、过氧乙酰硝酸酯(PAN)等二次污染物组成。光化学烟雾导致眼睛及粘膜受刺激,引发呼吸道疾病,严重时使人头痛、呕吐,甚至死亡。下列叙述中错误的是( )

A. 光化学烟雾的分散剂为空气
B. NO2为酸性氧化物
C. O2转化成O3的反应为非氧化还原反应
D. 汽车节能减排措施可以缓解光化学烟雾带来的污染
查看答案和解析>>
科目: 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表得第_____________族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为____________________,所含非金属元素的电负性由大到小的顺序是____________________。
(3)尿素分子中、碳原子为________杂化,分子中σ键与π键的数目之比为____________________。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是______。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为____________________。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如下图所示,则该物质的化学式为____________________。若晶体密度为dg·cm3,则晶胞中最近的两个碳原子的距离为____________________pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com