
科目: 来源: 题型:
【题目】(1)SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。利用电化学原理将CO、SO2转化为重要化工原料, 装置如图所示。
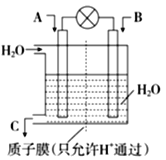
①若A为CO, B为H2,C为CH3OH,则通入CO一极的电极反应式为_____________。
②A为SO2, B为O2, C为H2SO4, 则负极反应式为________________。
③若A为NO2, B为O2, C为HNO3,负极的电极反应式为_________________。
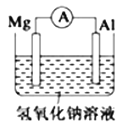
(2)下图所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g ,则放出气体______mol。
(3)利用反应Cu + Fe2(SO4)3=2FeSO4 + CuSO4设计一个原电池。
①在下面方格内画出实验装置图________________。

②指出正极材料可以为_____,该电极上发生的电极反应为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)上述反应中氧化剂和还原剂物质的量之比是______ ,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为______ 。
(2)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:__________________ .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且![]() 值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g质量分数为46%的乙醇水溶液中含有氧原子数为4NA
B. 若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C. 向大量水中通入1 mol氯气,反应中转移的电子数为NA
D. 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、C1-中的若干种,现取X溶液进行连续实验,实验过程及产物如图.说法正确的是

A. X中肯定存在Fe2+、A13+、NH4+、SO42- B. X中不能确定的离子是 A13+和C1-
C. 沉淀I一定是Al(OH)3 D. 溶液E和气体F不能发生化学反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2 加入量的变化如图所示。下列离子方程式书写正确的是

A. O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. A→B:2Al3++3SO42-+3Ba2+ +6OH-=3BaSO4↓+2Al(OH)3↓
C. B→C:NH4++SO42-+Ba2+ +OH-=BaSO4↓+NH3·H2O
D. D→E:NH4++ OH-=NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是

A. 最简单气态氢化物的热稳定性:Z>W
B. Y的最高价氧化物的电子式为:![]()
C. W的气态氢化物是强酸
D. X、M两种元素形成的简单离子半径大小顺序:X>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com