
����Ŀ��ʵ������ȡ����������Ũ����Ͷ������̷�Ӧ����������з�Ӧ��KClO3+6HCl(Ũ)�TKCl+3Cl2��+3H2O���÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢������ȣ�ͼ��ʵ�������ô˷�Ӧ�Ʊ�����������һϵ�����ʵ���װ��(�г��豸����)��

(1)������Ӧ���������ͻ�ԭ�����ʵ���֮����______ ������Ӧ����������Ȼ�ԭ����� 1mol����ת�Ƶĵ�����ĿΪ______ ��
(2)װ��B��������______ ��ʵ�����ʱC�п��ܷ�����������д����������ʱB�е�����_________________��
(3)װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т������������η���______ (ѡ��a����b������c��)
a | b | c | |
�� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
(4)���װ��D��E ��Ŀ����Ϊ�˱Ƚ�Cl2��Br2��I2��������ǿ������֪Br2��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��I2������ˮ�����ܱ�����I2�ı���ҺΪ�Ϻ�ɫ������D�л���ͨ������Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ��˵��Cl2�������Դ���Br2����д��D�ж�Ӧ�����ӷ���ʽ���õ����ŷ���ʾ������ת�������__________________ ���������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ�(����)Ϊ�Ϻ�ɫ��������______ (������������������)˵�� Br2�������Դ���I2��
(5)װ��F�������dz�ȥ��Ⱦ�Ե�����(Cl2��Br2��)����֪ Cl2��NaOH��Ӧʱ�����п�����NaCl��NaClO��NaClO3����![]() ֵ���¶ȸߵ��йأ����ձ���װ�� 500mL0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����Ϊ______ L(����Cl2����ˮ)��
ֵ���¶ȸߵ��йأ����ձ���װ�� 500mL0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����Ϊ______ L(����Cl2����ˮ)��
���𰸡�1:52.5NA���ӺͰ�ȫƿ��ƿ�е�Һ���½�������©���е�Һ������c![]() ����1.12
����1.12
��������
��1����KClO3+6HCl=KCl+3Cl2��+3H2O��Ӧ��KClO3��ClԪ�صĻ��ϼ���+5�۽���Ϊ0��HCl��ClԪ�صĻ��ϼ���-1������Ϊ0��
��2����Ӧ��ȡ�������к����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ����
��3����֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�
��4��D���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ���������װ��D��������Һ����װ��E�У����ɵ��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ���ܽ��ڱ��У��ֲ㣬�������ϲ㣻��������ǿ�����ԣ����ڹ���������Ҳ�ܹ����������ӣ���˵���嵥��������ǿ�ڵⵥ�ʣ�
��5������ԭ���غ������
��1����HCl��ClԪ�صĻ��ϼ����ߣ���HClΪ�÷�Ӧ�еĻ�ԭ����KClO3�е�Cl�Ļ��ϼ۽��ͱ���ԭ��KClO3������������������Ȼ�ԭ�������ʵ���֮��Ϊ5��1���������ͻ�ԭ�����ʵ���֮����1��5������Ӧ����������Ȼ�ԭ����� 1mol������������Ϊ1.25mol����ԭ����Ϊ0.25mol������ת�Ƶĵ�����ĿΪ2.5NA��
��2��װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ������ƿ��Һ���½�������©����Һ��������
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����ab�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ������
��4��D���������廯�Ʒ�Ӧ�����Ȼ��ƺ��嵥�ʣ���Ӧ�����ӷ���ʽ���õ����ŷ���ʾ������ת�������![]() ����������װ��D�к��嵥�ʵ�������Һ�����ʵ⻯�غͱ���װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ����������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����Ը�������˵����ķǽ�����ǿ�ڵ⣻
����������װ��D�к��嵥�ʵ�������Һ�����ʵ⻯�غͱ���װ��E�У��嵥�ʺ͵⻯�ط�Ӧ���ɵⵥ�ʣ��ⵥ�����ڱ����Ϻ�ɫ�����۲쵽�������ǣ�E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ����������ǿ�����ԣ������������ܹ��������������ɵⵥ�ʣ����Ը�������˵����ķǽ�����ǿ�ڵ⣻
��5����֪Cl2��NaOH��Ӧʱ�����п�����NaCl��NaClO��NaClO3����ԭ���غ��֪��n��Cl2��=1/2n��NaOH��=0.5L��0.2mol��L��1��1/2=0.05mol�������µ�Cl2�����Ϊ1.12L��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪŨ������ͭ��Ӧ�����������ʵ��װ�ã��ش��������⣺
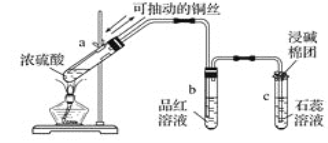
��1��ָ���Թ�a��b��c�в�����ʵ������
��a��__________________________��
��b��__________________________��
��c��__________________________��
��2��д��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д����������
A. Na+��Fe3+��SO42-��I- B. H+��Fe2+��SO42-��NO3-
C. K+��NH4+��CO32-��OH- D. Ca2+��Al3+��NO3-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڵ�����Ԫ��X��Y��Z����֪XԪ�ص�ԭ������ֻ��һ�����ӣ�YԪ�ص�ԭ��M���ϵĵ���������K���L�����������һ�룬ZԪ��ԭ�ӵ�L���ϵĵ�������YԪ��ԭ�ӵ�L���ϵĵ�������2������������Ԫ������ɵĻ�����Ļ�ѧʽ�����ܵ���(����)
A. X3YZ4 B. X3YZ3 C. X2YZ4 D. X4Y2Z7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�

����˵����ȷ����
A. �������е����ʷ������Ϊ����
B. Ĥ��Ӧ���У�����ѹǿ���������HI�ķֽ����ʺ�ƽ��ת����
C. �ù�����I2��HI���ת������������ѭ����
D. ��ѭ�����յ��ܷ�ӦΪ2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��ı��淽���������ǣ� ��
A.�������Ʊ�����ú����
B.�������ƹ����ܷⱣ��
C.�����Ȼ�������Һʱ����ͭ���Է�ֹ����
D.Ũ���ᱣ������ɫ�Լ�ƿ�в������䰵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת��һ����Ҫ��������������ʵ�ֵ��ǣ� ��
A.C ��CO2B.H2O2��O2C.SO2�� SD.KMnO4��MnO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ����(����)

A. ��ͼ��ʾ���ⶨ�к���ʱ����С���ձ���������ֽ������ĭ���ϵ�Ŀ���ǹ̶�С�ձ�
B. ����50 mL 0.55 mol��L��1������������Һ���ֱ���50 mL 0.50 mol��L��1�������50 mL 0.50 mol��L��1�������ַ�Ӧ������Ӧ�ⶨ���к��Ȳ����
C. Ϊ�˼�װ�ã��к��Ȳⶨʵ���еĻ��β���������������¶ȼƴ���
D. �к��Ȳⶨʵ��Ҳ������ϡ����������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�绯ѧ�����������Ĺ���ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
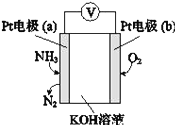
A. b������
B. a���ĵ缫��ӦʽΪ2NH3+3O2����6e���TN2+3H2O
C. ��Ӧ���ĵ�NH3��O2�����ʵ���֮��Ϊ4��5
D. �ô������ڹ���������KOH�����ʵ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com