
【题目】下列物质间的转化一定需要加入氧化剂才能实现的是( )
A.C →CO2B.H2O2→O2C.SO2→ SD.KMnO4→MnO2
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】对于反应A2(g)+3B2(g)===2C(g)来说,以下化学反应速率的表示中,反应速率最快的是( )
A. v(B2)=0.8 mol/(Ls)B. v(A2)=0.4 mol/(Ls)
C. v(C)=0.6 mol/(Ls)D. v(B2)=1 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0 ℃~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:
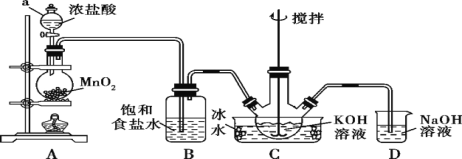
回答下列问题:
(1)制备KClO。
①仪器a的名称是________________;装置B吸收的气体是________。
②装置C中三颈烧瓶置于冰水浴中的目的是______________;装置D的作用是_____________。
(2)制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为________________________________。
②向装置C中加入饱和________溶液,析出紫黑色晶体,过滤。
(3)测定K2FeO4纯度。测定K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
a.FeO42-+CrO2-+2H2O═CrO42-+Fe(OH)3↓+OH-
b.2CrO42-+2H+═Cr2O72-+H2O
c.Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
称取2.0g制备的K2FeO4样品溶于适量KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250mL容量瓶中定容.取25.00mL加入稀硫酸酸化,用0.10 molL-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00mL,则该K2FeO4样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)上述反应中氧化剂和还原剂物质的量之比是______ ,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为______ 。
(2)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:__________________ .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且![]() 值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有 500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的________________(写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为__________________;
②控制反应在60℃进行,实验中可采取的措施是____________________;
③说明反应已完成的现象是_____________________ 。
(3)步骤2过滤需要避光的原因是_____________________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是____________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①_________________。
②___________________。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式中不能完全对应的是 ( )
A.酸性氧化物、三氧化硫、SO3B.碱性氧化物、过氧化钠、Na2O2
C.正盐、苏打、Na2CO3D.含氧酸、次氯酸、HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量的铁粉放入含三价铁离子溶液中,反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应的Fe3+物质的量之比是 ( )
A.1:2B.1:1C.3:2D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com