
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
【答案】SiO32- 粉碎、搅拌 中和过量的硫酸,调节溶液pH 2.5×10-9 mol·L-1<c(CO32-)≤1.6×10-3 mol·L-1 草酸钙难溶于水,而草酸锂易溶于水 2Li++CO32- = Li2CO3↓ 当c(Li+)=1.0×10-5mol·L-1时,c(CO32-)=1.6×10-3/(1.0×10-5)2=1.6×107 mol·L-1,远大于饱和Na2CO3溶液的浓度,故Li+没有沉淀完全 3Li2O +2Al![]() Al2O3 + 6Li 优点:反应速率快,Li浸出率高;相同浸取率需要的反应温度低,消耗能量少。
Al2O3 + 6Li 优点:反应速率快,Li浸出率高;相同浸取率需要的反应温度低,消耗能量少。
缺点:Al浸出率较高,需要增加除Al杂质的步骤
【解析】
β-锂辉矿(主要成分为LiAlSi2O6,还含有少量MgO、CaCO3等杂质)为原料来制取金属锂,加入过量浓硫酸溶解β-锂辉矿,加入碳酸钙再加入适量石灰乳,使镁离子沉淀完全,加入稀碳酸钠沉淀钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后煅烧得到氧化铝,加入铝粉高温条件下置换出锂同时生成氧化铝。(1)β-锂辉矿的主要成分LiAlSi2O6为硅酸盐,存在的原子团为SiO32-;(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为粉碎、搅拌。浸出液中加入CaCO3的主要作用为中和过量的硫酸,调节溶液pH,使于除去镁离子;(3) 反应Ⅱ应该控制钙离子沉淀完全而锂离子没有开始沉淀,溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,Ksp(CaCO3)= c(Ca2+) c(CO32-)=2.5×10-9,得c(CO32-)=2.5×10-9,Ksp(Li2CO3)= c2(Li+) c(CO32-)= 1.6×10-3, 得c(CO32-)=1.6×10-3,故理论上c(CO32-)应控制的范围为2.5×10-9 mol·L-1<c(CO32-)≤1.6×10-3 mol·L-1;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,因为草酸钙难溶于水,而草酸锂易溶于水;(4)反应Ⅲ是碳酸钠与硫酸锂反应生成碳酸锂和硫酸钠,反应的离子方程式为2Li++CO32- = Li2CO3↓;当c(Li+)=1.0×10-5mol·L-1时,c(CO32-)=1.6×10-3/(1.0×10-5)2=1.6×107 mol·L-1,远大于饱和Na2CO3溶液的浓度,故Li+没有沉淀完全;(5)高温下发生反应Ⅳ的化学方程式为3Li2O +2Al![]() Al2O3+ 6Li;(6) 酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优点:反应速率快,Li浸出率高;相同浸取率需要的反应温度低,消耗能量少;缺点:Al浸出率较高,需要增加除Al杂质的步骤。
Al2O3+ 6Li;(6) 酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优点:反应速率快,Li浸出率高;相同浸取率需要的反应温度低,消耗能量少;缺点:Al浸出率较高,需要增加除Al杂质的步骤。


科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A. Na+、Fe3+、SO42-、I- B. H+、Fe2+、SO42-、NO3-
C. K+、NH4+、CO32-、OH- D. Ca2+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扑热息痛是一种优良的解热镇痛药,其结构简式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
A. 它能与烧碱溶液反应
B. 它能与溴水发生取代反应
C. 该物质是由两分子氨基酸脱水缩合而成
D. 它遇FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________,E元素在周期表中的位置为____________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示.下列说法正确的是( )
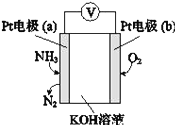
A. b极为负极
B. a极的电极反应式为2NH3+3O2﹣﹣6e﹣═N2+3H2O
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 该传感器在工作过程中KOH的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHC03与Na2C03的性质,下列叙述中不正确的是
A. Na2C03和NaHC03粉末与同浓度盐酸反应时,Na2C03因碱性强,所以与盐酸反应放出气体速度快
B. 等物质的量的两种盐与同浓度盐酸反应,Na2C03所消耗盐酸的体积是 NaHC03的两倍
C. 向Na2C03饱和溶液中通人过量CO2,有NaHC03结晶析出
D. Na2C03和NaHC03溶液分别和BaCl2溶液反应,现象不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com