
【题目】有关NaHC03与Na2C03的性质,下列叙述中不正确的是
A. Na2C03和NaHC03粉末与同浓度盐酸反应时,Na2C03因碱性强,所以与盐酸反应放出气体速度快
B. 等物质的量的两种盐与同浓度盐酸反应,Na2C03所消耗盐酸的体积是 NaHC03的两倍
C. 向Na2C03饱和溶液中通人过量CO2,有NaHC03结晶析出
D. Na2C03和NaHC03溶液分别和BaCl2溶液反应,现象不同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰干电池的结构如图所示。回答下列问题。
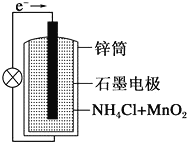
(1) ①电池中电解质溶液为________。
②正极反应式为_______________。
③放电时,NH4+向______(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是____,原因是____。若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是_____(填序号)。
A.微热 B.加入适量氧化铜
C.加入少量硫酸铜溶液 D.加水
E.加入少量氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀;
已知:向Ag+溶液中滴加氨水,先产生沉淀,继续滴加氨水,沉淀溶解。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是_____;所含阴离子相同的两种盐的化学式是________。
(2)D的化学式为____________,D溶液显碱性的原因是(用离子方程式表示)_____________。
(3)A和C的溶液反应的离子方程式是_______________;E和氨水反应的离子方程式是_______________。
(4)若要检验B中所含的阳离子,正确的实验方法是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X + 的核外电子排布为 2、8、8,则X位于周期表的位置是( )
A. 第四周期第 IA 族 B. 第三周期第 0 族
C. 第三周期第 IA 族 D. 第三周期第 VIIA 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
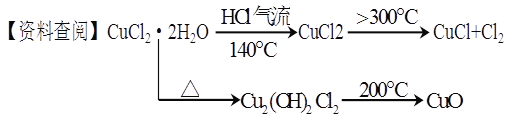
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.Cl2+H2O=HClO+HCl
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com