
【题目】在下列化学反应中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.Cl2+H2O=HClO+HCl
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示.下列说法正确的是( )
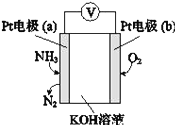
A. b极为负极
B. a极的电极反应式为2NH3+3O2﹣﹣6e﹣═N2+3H2O
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 该传感器在工作过程中KOH的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHC03与Na2C03的性质,下列叙述中不正确的是
A. Na2C03和NaHC03粉末与同浓度盐酸反应时,Na2C03因碱性强,所以与盐酸反应放出气体速度快
B. 等物质的量的两种盐与同浓度盐酸反应,Na2C03所消耗盐酸的体积是 NaHC03的两倍
C. 向Na2C03饱和溶液中通人过量CO2,有NaHC03结晶析出
D. Na2C03和NaHC03溶液分别和BaCl2溶液反应,现象不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL 0.1mol/L的H2A溶液中滴加0.1mol/LNaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
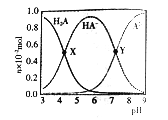
A. H2A在水中的电离方程式是:H2A=H++HA-, HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. Y点溶液中存在以下关系: c(H+)+c(Na+)=c(OH-)+3c(HA-)
D. X点溶液中含A元素相关微粒:c(H2A)+c(HA-)+c(A2-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成,取一定量的固体甲进行如下实验:
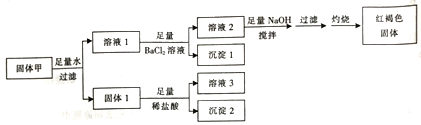
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g。下列说法正确的是
A. 溶液1加入KSCN溶液呈红色
B. 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl
C. 固体1与稀盐酸反应时还生成了标准状祝下气体1.12L
D. 沉淀2不溶于任何酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4 mol/L,O2为 0.2 mol/L
B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L
D. SO3为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨都能燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.下列说法正确的是 ( )
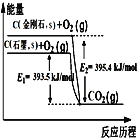
A. 金刚石和石墨互为同素异形体,它们之间的转化属于化学变化
B. 金刚石比石墨稳定
C. 相同物质的量的金刚石比石墨所含有的能量低
D. 由金刚石制取石墨放出1.9 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起。某研究小组按照以下流程对粉末丙进行研究:
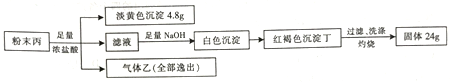
已知:气体乙可溶于水,标准状况下的密度为1.52g/L。
请回答下列问题:
(1)化合物甲的化学式为___________。
(2)化合物丙在盐酸中反应的离子方程式:____________。
(3)化合物丁还可用于氧化法制备高铁酸钾(K2FeO4),试写出在KOH存在条件下用次氯酸钾氧化化合物丁制备高铁酸钾的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是
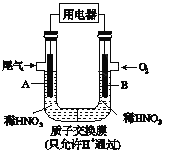
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com