
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
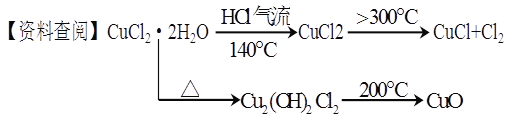
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
【答案】(1)球形干燥管;(2)c、d、b;(3)先逐渐变为红色,后褪色;(4)Cl2+2OH-=Cl-+ClO-+H2O;(5)①加热温度不够;②没有在HCl的氛围中加热。
【解析】试题分析:(1)根据仪器X的构造特点知其名称为干燥管,答案为:干燥管。
(2)加热CuCl2·2H2O制备CuCl,为防止生成的CuCl被空气中的氧气氧化和Cu+水解,必须要先通入干燥的HCl气体赶走装置中的空气再加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,继续通入氮气直至装置冷却,所以操作顺序为:a-c-d-b-e,答案为:c d b。
(3)B中物质由白色变为蓝色,说明有水生成,产物中还有Cl2,所以C中石蕊试纸先逐渐变为红色,后褪色,答案为:先变红,后褪色。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,答案为:Cl2+2OH-=Cl-+ClO-+H2O。
(5)①根据题给信息知若杂质是CuCl2,说明CuCl2没有反应完全,原因为加热时间不足或温度偏低,答案为:加热时间不足或温度偏低;②若杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO,原因是通入HCl的量不足,答案为:通入HCl的量不足。


科目:高中化学 来源: 题型:
【题目】有机物E(C6H8O4)广泛应用于涂料行业中,某同学设计如下路线合成E(其中A的相对分子质量是56,B的相对分子质量比A大69).![]()
(1)烃A的分子式是 .
(2)③的反应类型是反应.
(3)已知E为顺式结构,则用结构简式表示其结构是 .
(4)下列说法正确的是(填序号).a.反应①属于取代反应 b.B与二氯甲烷互为同系物
c.C不存在羧酸类同分异构体 d.D能发生缩聚反应
(5)若C转化为D经过如下4步反应完成:C ![]()
![]()
![]()
![]() D.则⑥所需的无机试剂及反应条件是;④的化学方程式是 .
D.则⑥所需的无机试剂及反应条件是;④的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( ) 
A.a﹣b时沉淀的物质的量:Al(OH)3比BaSO4多
B.b﹣c时溶液中离子的物质的量:AlO2﹣比Ba2+多
C.a﹣d时沉淀的物质的量:Al(OH)3一定小于BaSO4
D.d﹣e时溶液中离子的物质的量:Ba2+可能等于AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定:( )
①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量.
A. ①②B. ①③C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( ) 
A.t5时增大了压强
B.t3时降低了温度
C.t2时加入了催化剂
D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
相关信息 | |
X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
Y | 含Y元素的物质焰色反应为黄色 |
Z | 同周期元素中原子半径最小 |
R | R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是 , Y、Z、R简单离子的半径从大到小的顺序是(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2 , 其溶液显黄色.则Y2R2的电子式为 , 写出乙溶液在空气中变质过程的化学方程式 . Ⅱ、元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2 . 写出其爆炸的化学方程式;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76gL﹣1 , 则物质丁的化学式为;
(6)戊在高温条件下能还原Fe2O3 , 生成两种单质,写出该反应的化学方程式 , 有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,其原子半径、化合价等信息见下表。
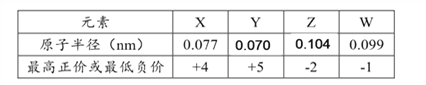
有关这四种元素的说法一定正确的是( )
A. X与W形成的化合物是离子化合物
B. Y的氢化物能与W的氢化物反应,所得产物只含有共价键
C. X、Y能分别与氧元素形成多种氧化物
D. Z处于元素周期表中第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关比色法测样品纯度的说法正确的是( )
A.比色法的优点是灵敏度高,缺点是误差较大
B.无色金属离子都不能用比色法测定
C.酸性溶液中的H+的显色剂可用酚酞代替石蕊
D.配制抗贫血(含Fe2+)药片样品溶液,加入硝酸的目的是防止Fe2+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验.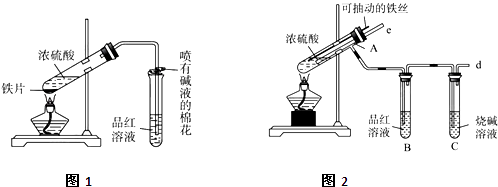
(1)比较两个实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2防止其污染环境;
②;
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是;
(3)能说明有SO2气体产生的实验现象是;
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;
Ⅱ:只含有Fe2+;
Ⅲ:既有Fe3+又有Fe2+ .
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液
B.稀硫酸
C.KSCN溶液
D.酸性KMnO4溶液
E.NaOH溶液
F.淀粉KI溶液
G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的 , 根据溶液颜色的变化可确定假设Ⅱ是否正确.
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色变色,则试样中含有Fe3+发生反应的离子方程式为;
步骤2.再取适量的试样滴加少量的(填试剂序号),溶液颜色的变化为 , 则试样中含有Fe2+ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com