
科目: 来源: 题型:
【题目】Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+![]() O2(g)=CO(g)ΔH =–110.4kJmol-1,
O2(g)=CO(g)ΔH =–110.4kJmol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
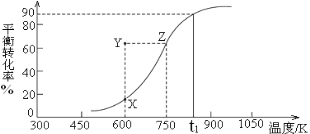
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, 温度为t1时,该反应的平衡常数K=____________。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______极,阴极的电极反应式为_______________。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________mol/L(保留至小数点后一位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组,利用如图所示装置探究元素非金属性强弱的变化规律。
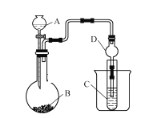
(1)仪器A的名称为_________,干燥管D的作用是_____。
(2)实验室中现有药品Na2S、浓盐酸、稀硫酸、MnO2,请选择合适药品设计实验探究氯和硫的非金属性强弱(必要时可以加热,图中省略):
①装置A中所装药品为_________。
②装置C中的实验现象为:有淡黄色沉淀生成,该装置中的化学反应方程式为__________。
③根据该实验探究出的结果,可知HCl的稳定性比H2S的稳定性____。(填“强”或“弱”)
(3)若要探究硫和碳元素的非金属性强弱,B、C中所装药品分别为Na2CO3固体、澄清石灰水,则A中反应的离子方程式为__________,观察到C装置中的现象为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强B.原子序数为34
C.氢化物比HBr稳定D.最高价氧化物的水化物显碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
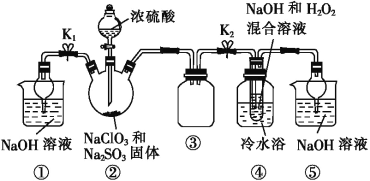
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】含有氨基(—NH2)的化合物通常能够与盐酸反应,生成盐酸盐,如:R—NH2+HCl―→R—NH2·HCl(R代表烷基、苯环等)。
现有两种化合物A和B,它们互为同分异构体。已知:
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;
④它们的组成元素只可能是C、H、O、N、Cl中的几种。
请按要求填空:
(1)A和B的分子式是________________。
(2)A的结构简式是_____________________________;
B的结构简式是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置能达到实验目的的是
A. 用如装置将氯化铁溶液直接蒸干得到氯化铁固体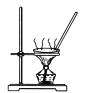
B. 用如图装置制备Fe(OH)2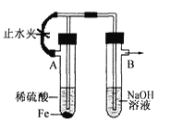
C. 用如图装置除去CO2中含有的少量HCl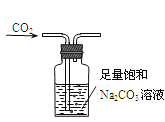
D. 用如图装置配制100mL 0.1mol/L的稀硫酸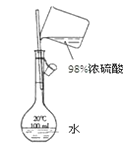
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/mol,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
A.温度B.压强C.焓变D.熵变
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如下图所示:
bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b=______。
(2)若t2-t1=10 min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为_______mol/(L·min)。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com