
科目: 来源: 题型:
【题目】甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下88gCO2和足量氢气完全反应可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量。 请回答:
(1)该反应的热化学方程式: __________________________________________。
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图。请回答:
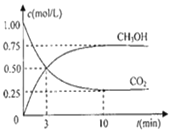
①从反应开始到平衡,氢气的反应速率:υ(H2)=______。
②下列措施中能使υ(CO2)增大的是______。
A 加入催化剂 B 充入He(g),使体系压强增大
C 将H2O(g)从体系中分离 D 升高温度
③能够说明该反应已达到平衡的是______。
A 恒温、恒容时,容器内的压强不再变化 B 恒温、恒容时,容器内混合气体的密度不再变化 C 一定条件下,CO2、H2和CH3OH的浓度不再变化 D 一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH E 有2个C=O键断裂的同时,有3个H-H键断裂
(3)甲醇—空气碱性燃料电池在生活中有着广泛的应用,写出该电池正极的电极反应式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组设计如图所示装置发生铜与稀H2SO4的反应。该装置工作时,下列说法正确的是( )
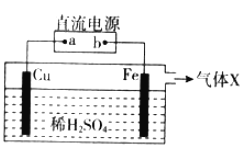
A. a为直流电源的正极B. 气体X为O2
C. SO42-向Fe电极附近移动D. 该装置能证明Cu比Fe活泼
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是( )
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
B. Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() AlCl3(aq)
AlCl3(aq)
C. NH3![]() NO
NO![]() HNO3
HNO3
D. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
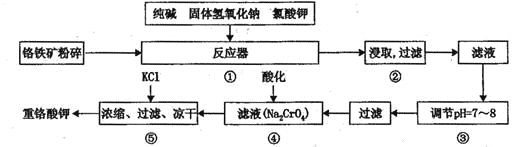
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯是重要的化工原料,其分子结构具有对称美,下列说法正确的是( )
A.苯分子中只含有碳碳单键B.苯能与溴水发生取代反应
C.苯分子中所有原子位于同一平面D.苯能使KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置和方法进行相应实验,能达到实验目的的是()
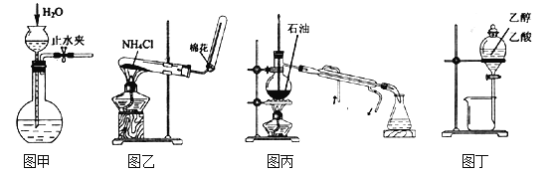
A. 用图甲所示方法检查装置的气密性
B. 用图乙所示装置制取氨气
C. 用图丙所示装置分馏石油获得汽油
D. 用图丁所示装置分离乙醇与乙酸
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的能量变化示意图如下,有关说法正确的是( )
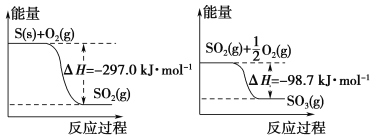
A. 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+395.7 kJ·mol-1
SO3(g) ΔH=+395.7 kJ·mol-1
D. 一定条件下1 mol SO2(g)和![]() mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是常见的无机强酸,是重要的化工原料。实验室模拟硝酸的制备可用以下装置,其中a为一个可持续鼓入空气的橡皮球,b、c为止水夹。

(1)实验开始前,应检验装置的气密性,请写出检验A~E装置(不必考虑a)的气密性方法________________。
(2)装置A中发生反应的化学方程式为___________。装置C中浓硫酸的作用是__________。
(3)实验进行一段时间,待制备一定量硝酸后,停止加热A和B中装置,但仍要通过a鼓入一定量的空气,该操作的目的是____________________。
(4)若F装置中所选用试剂为酸性KMnO4溶液,请写出F装置处理NO尾气的离子方程式:_____________________。
(5)欲使A中产生的氨气尽可能转化为硝酸,理论上氨气与鼓入空气的最佳比例为_______。
(6)实验完毕后,取E中的溶液,加入几滴酚酞溶液,用0.10 mol/L的NaOH标准液滴定,发现加入过量标准液后仍无现象,试解释没有观察到滴定终点的原因_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com