
科目: 来源: 题型:
【题目】5种物质已按沸点由低到高顺序排列),则正己烷最可能插入的位置是( )
① | ② | ③ | ④ | ⑤ |
甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 甲苯 |
A.③④之间B.②③之间C.④⑤之间D.⑤之后
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在下列各组物质中:
A O2和O3 B 氘和氚 C CH4和CH3(CH2)2CH3
D ![]() 和
和![]() E CH3(CH2)2 CH3和
E CH3(CH2)2 CH3和![]()
①互为同位素的是__________ ②互为同素异形体的是______.
③互为同系物的是__________ ④互为同分异构的是_____.(均填选项号)
(2)下列各种物质:①H2O②NH3③KOH④Na2O2 ⑤MgCl2⑥Ne ,不存在化学键的是_____;只存在离子键的是_____;属于共价化合物的是_______;含非极性键的离子化合物是__________________。
(3)CO2的电子式为 ________________;NH3的结构式为 _______________;
(4)Na2O2熔化时被破坏的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是
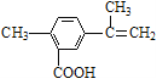
A. 在一定条件下,能发生取代、酯化和加聚反应
B. 该物质能使酸性KMnO4溶液褪色
C. lmol该物质最多可与5molH2发生加成反应
D. lmol该物质完全燃烧最多可消耗13mol氧气
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 31 g白磷(![]() )含有共价键的总数为1.5NA
)含有共价键的总数为1.5NA
B. 常温下,22.4 mL H2O中所含氢氧键的数目约为2.49NA
C. 8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-选修5:有机化学基础]有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰②F的结构简式为:

③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④![]()
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)写出反应IV中的化学方程式____________________________________________。
(6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. 一定温度下,弱酸的电离常数越大,酸性越强
B. 醋酸的电离常数Ka和醋酸钠的水解常数Kh之间的关系为:Ka·Kh=Kw
C. 平衡常数只受温度影响,与反应物或生成物的浓度无关
D. 合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A、B同主族,C、D同周期,B、E同周期。气体A2与气体C2混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B、C、E简单离子的核外电子排布相同。E的最高价氧化物可与B的最高价氧化物的水化物反应生成一种易溶于水的的盐,D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B两种元素的元素名称:A________、B________写出D的最高价氧化物的电子式___________。
(2)写出由B和C两元素形成的原子个数比为1:1的化合物F存在的化学键是_______________________
(3)写出F和A2C反应的离子方程式:________________________________。
(4)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:

①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com