
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )

A. Y单质与氢气反应较Z缓和
B. 最高价氧化物对应水化物酸性W比Z强
C. X单质氧化性强于Y单质
D. X与W的原子核外电子数相差9
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某气态烃X在标准状态下的密度为1.16 g/L,A能发生银镜反应,E具有特殊香味,有关物质的转化关系如下:

请回答:
(1)B中含有的官能团名称是_____________,反应④的反应类型为_____________。
(2)写出反应①的化学方程式_____________。
(3)下列说法正确的是_____________。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B与C在一定条件下可以反应生成有机物E
D.有机物E中混有B和D,可用NaOH溶液将E分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示内容不对应的是
选项 | A | B | C | D |
晶体名称 | 干冰 | 石墨 | 碳酸钠 | 晶体氩 |
构成粒子 | 分子 | 原子 | 离子 | 分子 |
晶体内存在的作用力 | 共价键、 范德华力 | 共价键 | 共价键、离子键 | 范德华力 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计方案或判断中正确的是
A.加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3
B.通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体
C.某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42-
D.未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:

则关于原溶液的判断中不正确的是
A. 是否存在 Na+、K+需要通过焰色反应来确定
B. 通过CCl4 层的颜色变化,也能判断出原溶液中是否存在Fe3+
C. 虽然实验过程引入了氯元素, 但不影响原溶液是否存在Cl-的判断
D. 肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E 为短周期主族元素,其原子序数依次增大;B、C、D、E 位于同一周期; A 的简单气态氢化物可以用作制冷剂;1 mol B 单质与足量盐酸反应生成气体在标准状况下的体积为33.6 L;D 原子最外层电子数与核外电子总数之比为 3∶8;C 的原子子序数是 A 的两倍。
(1)A、B 简单离子半径由大到小的顺序为______________ (填离子符号) 。
(2)C 在元素周期表中的位置是_______________ 。
(3)A 的简单气态氢化物接触到 E 的简单气态氢化物时可观察到的现象是_____________。
(4) D 与 E 可形成原子个数比为 1∶2 的化合物,其电子式为________。
(5)C、D、E 最简单气态氢化物稳定性由高到低的顺序是___________ (用化学式表达 )。
(6)B 与 D 形成的化合物遇水迅速水解,写出该反应的化学方程式_______________________。
(7)若 E 单质与 NaOH 溶液反应生成 NaE、NaEO 和 NaEO3,则 30mL 2mol/LNaOH 与_____mol E 单质恰好完全反应(忽略 E 单质与水的反应及盐类的水解反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2为无色、有强烈刺激性气味的气体,是主要大气污染物之一,具有一定的还原性。
I. 探究 SO2 还原 Fe3+、I2。可使用的药品和装置如下图所示。

(1)实验室常用亚硫酸钠与 70%硫酸 加热制备二氧化硫,写出该反应的化学方程式_________________________________。
(2)B中可观察到的现象是__________________。
(3)C的作用是______________。
(4)设计实验检验A 中SO2与Fe3+反应所得还原产物____________________。
Ⅱ.某同学将SO2与漂粉精进行如下实验探究。
操 作 | 现 象 |
取适量漂粉精固体,加入 100 mL 水 | 大部分固体溶解,溶液略有颜色 |
过滤,用 pH 试纸测漂粉精溶液的 pH | pH 试纸先变蓝(约为12),后褪色 |
将 SO2 持续通入漂粉精溶液中 | ①溶液出现浑浊,并呈淡黄绿色 |
②一段时间后,产生较多白色沉淀,黄绿色褪去 | |
(1)由 pH 试纸颜色变化说明漂粉精溶液具有的性质是______________________________。
(2)①中溶液呈淡黄绿色的可能原因是_________________________________;用离子方程式解释②中溶液黄绿色褪去的主要原因___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
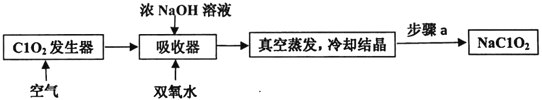
下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com