
科目: 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是
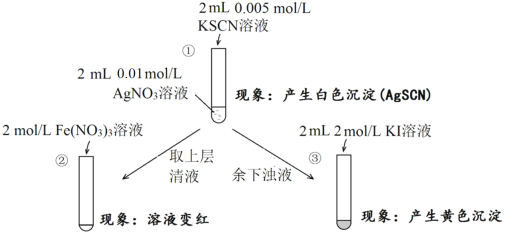
A.①浊液中存在平衡:AgSCN(s)![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 此装置可实现 铜的精炼 | 盐桥中的K+ 移向FeCl3溶液 | 若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg原子最外层电子数为_____,反应中容易________个电子而显示_____价; F原子最外层电子数为_____,反应中容易__________个电子而显示_____价。在上述过程中,F原子和 Mg原子通过_____________都形成了8电子稳定结构。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是
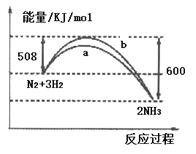
A. 在温度、体积一定的条件下,通入1mol N2和3mol H2 反应后放出的热量为92kJ
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,也不能提高N2的转化率
D. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣92 kJ/mol
2NH3(g) △H=﹣92 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用化学沉降法处理酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在),同时从沉渣中还可以提取出常用的中药药剂As2O3,基本实现了废水处理过程的“三废”零排放。工艺流如下:

回答下列问题:
(1)H3AsO3中,砷元素的化合价为__________
(2)H3AsO3是三元弱酸,第一步和第二步电离是通过和水中的OH-结合实现的,第三步则直接电离出H+,第一步电离方程式为H3AsO3+H2O![]() [As(OH)4]-+H+,则第二步电离方程式为________________________________。
[As(OH)4]-+H+,则第二步电离方程式为________________________________。
(3)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
(4)“二级沉砷”后,滤渣A的主要成分,除含有Ca3(AsO4)2 、FeAsO4、Fe(OH)3外,还有________(写化学式)。
(5)写出Ⅳ过程中,由Na3AsO4制备As2O3 的离子方程式 ____________________________ 。
(6)砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 , K2=1.7×10-7 , K3=4.0×10-12, Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
(7)雌黄(As2S3)和雄黄(As4S4 )是自然界中常见的砷化物,一定条件下,两者的转化关系如下图所示。若反应Ⅱ中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2C12)常用于制造医药品、染料等。通常情况下其熔点为-54.1℃,沸点69.2℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:
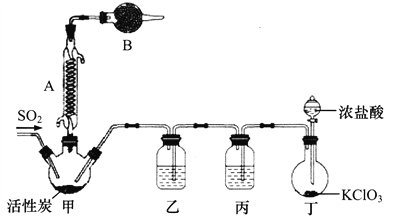
(1)B中的试剂为___________,作用为______________________________。
(2)在不改变装置的前提下,丁中的KClO3可用_____________代替(填化学式)。
(3)该小组向Cu(NO3)2·3H2O晶体中滴加SO2C12制备少量无水Cu(NO3)2。
①请写出SO2C12与水反应的化学方程式__________________________________。
②滴加SO2C12的作用除了吸水之外,还有_____________________________。
(4)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示(已知4NH3·H2O+Cu2+==[Cu(NH3)4]2++4H2O)。
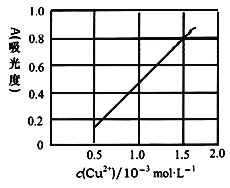
称取0.3150g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100mL溶液,用__________(填仪器名称)准确量取10.00mL,加过量氨水,再用蒸馏水稀释至100mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是___________(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ | ⑩ |
(1)写出元素符号:②________,⑦_______。
(2)①的原子结构示意图为_________,⑤的离子结构示意图为________。
(3)元素⑨的最高价氧化物对应的水化物的电子式为________。
(4)元④、⑧、⑩的氢化物的沸点由高到低的顺序为_________(填化学式)。
(5)写出元素③和⑥形成的化合物与元素⑤的最高价氧化物对应的水化物反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
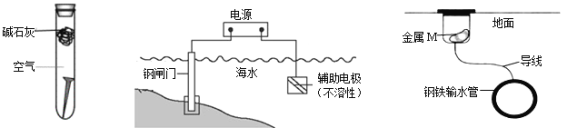
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析不正确的是
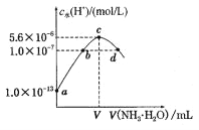
A. 硫酸的浓度为0.05mol/L
B. V=20
C. c点所示的溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d点所示溶液中:c(NH4+)=c(SO42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com