
科目: 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目: 来源: 题型:
【题目】B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在。
(1)基态硅原子的电子排布式为________________;C、N、O元素原子的第一电离能由大到小的顺序为________________;写出一种与CO32-互为等电子体的阴离子:_________;
(2)BF3与一定量的水可形成如图所示晶体R

①晶体R中各种微粒间的作用力涉及___________(填字母代号),
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R中阴离子的空间构型为________________________;
(3)乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图所示),乙二胺分子中氮原子的杂化类型为________________;
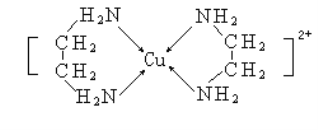
乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是__________;
查看答案和解析>>
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag+ (aq) + Cu(s) == Cu2+ (aq) + 2Ag (s)设计的原电池如下图。

请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_____________;
(2)银电极为电池的_________极;银电极上发生的电极反应式______________。
(3)外电路中的电子是从________电极流向______电极(填电极的材料)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对下图中两极加以必要的连接并填空:

(1)在图A中,使铜片上产生氢气。
①若加以导线连接,则锌片发生____________(填“氧化”或“还原”);铜片上的电极反应式:____________________________。
②若外加电源,则铜片作为该装置的______极,连接电源的_______极;锌片上发生的电极反应式为________________________。
(2)在图B中,使a极析出铜。

①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为____________(填“原电池”或“电解池”);该装置工作时,溶液中阴离子向________极作定向移动(填“a”或“b”); 经过一段时间后,停止反应并搅匀溶液,溶液的酸性__________ (填“增强”、“降低”或“不变”)。
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为________电极(填序号)。
A.铂 B.铁 C.石墨 D.银 E.锌
该装置工作时,溶液中阴离子向________极作定向移动(填“a”或“b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g) ![]() 3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
浓度/ mol·Lˉ1 时间/min | c(A) | c(B) | c(C) |
0 | 1.0 | 1.2 | 0 |
2 | 0.8 | ||
4 | 0.6 | ||
6 | 0.9 |
A.0~2 min内,B的反应速率为0.1 mol·Lˉ1·minˉ1
B.2 min时,C的物质的量浓度为0.4 mol·Lˉ1
C.4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D.4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。
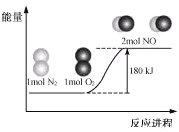
下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH1=-221 kJ·molˉ1
4Al(g)+3O2(g) =2Al2O3(s) ΔH2=-3351 kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成 AlN 的总热化学方程式是___________________;
(2) “亚硫酸盐法”吸收烟气中的SO2,室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

请写出a点时n(HSO3-)∶n(H2SO3)=______,b点时溶液pH=7,则n(NH4+)∶n(HSO3-)=______;
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为:4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4∶l、3∶l、1∶3时,得到NO脱除率曲线如图所示:

①请写出N2的电子式________;
② 曲线c对应NH3与NO的物质的量之比是______;
③曲线a中NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___________mg·m-3·s-1;
(4)间接电化学法可除NO。其原理如上右图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)__________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:

(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为_________________kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:________________________________。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为:_____________________。当有16 g O2(g)生成时,该反应中放出的热量为:_________________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: ①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJmol-1
②P(S,红磷)+5/4O2(g)=1/4P4O10(s) △H = —738.5kJmol-1
(1)写出白磷转化为红磷的热化学方程式:___________________________________。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A~D]________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com