
科目: 来源: 题型:
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂_______,离子方程式:____________________________________。
(2)CO2(HCl)试剂___________,离子方程式:__________________________________。
(3)O2(CO2)试剂__________,离子方程式:____________________________________。
(4)SO42-(CO32-)试剂_______,离子方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在生产生活中氮及其化合物的应用和处理已引起广泛关注。
(1)合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。

A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
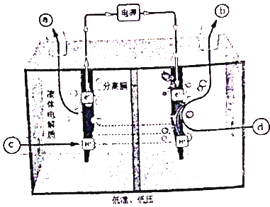
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________。
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g)![]() 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)的ΔH = ________。
4N2(g)+6H2O(g)的ΔH = ________。
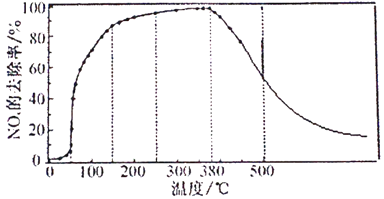
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中不正确的是( )
A. 盐酸滴在石灰石上:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 向Ba(OH)2溶液中滴入少量的NaHSO4溶液:H++SO42-+Ba2++OH-![]() BaSO4↓+H2O
BaSO4↓+H2O
C. 向Ba(OH)2溶液中滴入过量的NaHSO4溶液:2H++SO42-+Ba2++2OH-![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 稀硫酸滴在铜片上:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)求原混合液中Na2SO4的物质的量?__________________
(2)产生的气体在标准状况下的体积为多少?_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为_________。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是____________。
(3)试剂Ⅲ的名称是________,③中发生反应的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制500mL 1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,__________;________。
(2)玻璃棒在该实验中有重要的用途,分别是__________和 _________;
(3)小王同学通过计算,用托盘天平称取________gCuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将_________;
②定容时,若眼睛俯视,则所配制的溶液浓度将___________;
③摇匀后以免低于刻度线,再加入少量水________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分别取质量为a g的Fe2O3和CuO的混合固体粉末,进行如下实验:
(1)固体粉末在加热条件下用足量的CO还原,得到金属混合物b g,将生成的CO2气体用足量的澄清石灰水吸收后,产生c g白色沉淀。则a = ________g(用含b、c的代数式表示)。
(2)固体粉末溶于足量盐酸后,加入适量的铁粉,所得溶液中的金属离子只有Fe2+,同时收集到224 mL H2(标准状况下),共用去0.03 mol铁粉。则原混合物中Fe2O3的物质的量是________(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】己二酸是合成尼龙66的重要原料。以环己烯为原料,可以与多种氧化剂反应得到己二酸(反应均在一定条件下进行)。下列氧化剂中可以称为绿色化学试剂的是( )
A.高锰酸钾B.过氧化氢C.硝酸D.重铬酸钾
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应:A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A的体积分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】4℃时在100mL水中溶解了22.4L氯化氢气体(在标准状况下测得)。下列关于所形成的溶液说法中,正确的是( )
A. 该溶液溶质的物质的量浓度为10mol·L-1
B. 若已知该溶液的密度,则可求得溶液溶质的物质的量浓度
C. 该溶液中含有0.1mol的Cl-
D. 该溶液的体积为22.5L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com