
【题目】在一定温度下,下列叙述不是可逆反应:A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A的体积分数不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
【答案】A
【解析】
①C生成的速率相当于v(正),C分解的速率相当于v(逆),且v(正)= v(逆),可以判定反应达到平衡状态,正确;
②单位时间内生成a mol A,同时生成3a mol B,反应速率同向,不能判断反应是否达到平衡状态,错误;
③A、B、C的浓度不再变化,可以判定反应达到平衡状态,正确;
④A的体积分数不再变化,浓度保持不变,可以判定反应达到平衡状态,正确;
⑤该反应为反应前后气体体积发生变化的反应,当混合气体的总压强不再变化时,可以判定反应达到平衡状态,正确;
⑥该反应中各物质均为气体,反应前后气体的总量发生变化,所以当混合气体的总物质的量不再变化,可以判断反应达到平衡状态,正确;
⑦单位时间内消耗a mol A,相当于v(正),同时生成3a mol B ,相当于v(逆),且速率之比和系数成正比,因此可以判定反应达到平衡状态,正确;
⑧平衡时各组成成分的含量不再改变,但不一定等于化学式前的系数之比,不能判断反应是否达到平衡状态,错误;
综上所述,本题选A。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
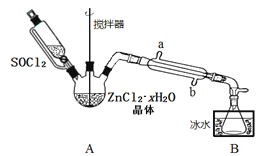
①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
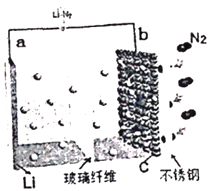
A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。有关该反应的说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。有关该反应的说法正确的是( )
A. H2C2O4是还原剂B. KClO3在反应中失电子
C. KClO3被还原D. H2SO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)求原混合液中Na2SO4的物质的量?__________________
(2)产生的气体在标准状况下的体积为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行物质制备时,下列从原料及有关试剂分解制取相应的最终产物的设计中,理论上有错误或操作上不可行或经济上不合理的是( )
A. FeFe2O3 ![]() Fe2(SO4)3溶液
Fe2(SO4)3溶液
B. C![]() CO
CO![]() CO2
CO2![]() Na2CO3溶液
Na2CO3溶液
C. CuO![]() CuSO4溶液
CuSO4溶液![]() Cu
Cu
D. CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的含义表示正确的是
A. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H(中和热)
B. NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) △H(中和热)
Na2SO4(aq)+H2O(l) △H(中和热)
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H(燃烧热)
D. 2H2(g)+O2(g)=2H2O(g) △H(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的_________。
A.用石斧解剖 B.早期的农业耕作
B.早期的农业耕作
C.简单机械织布![]() D.祥云火炬燃烧
D.祥云火炬燃烧![]()
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
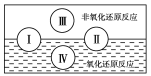
试写出一个有水生成的属于类型Ⅲ的化学方程式_________;
有水参加的反应:C+H2O(g)![]() CO+H2,符合图中反应类型______(填标号)。
CO+H2,符合图中反应类型______(填标号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com