
科目: 来源: 题型:
【题目】目前处理烟气中的SO2有三种方法:液吸法、还原法、电化学法。
I.液吸法
25℃,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5
第1步:用过量浓氨水吸收SO2,并在空气中氧化。
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-![]() CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
(1)25℃,(NH4)2SO3溶液呈___________(填“酸性”、“碱性”、“中性”)
(2)通过计算第2步反应的K判断第2步反应___________(填“能”或“不能”)进行完全。(一般认为K>105时反应就进行完全了。)
Ⅱ.还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=-37.0kJ·mo1-1
S(l)+2CO2(g) △H1=-37.0kJ·mo1-1
②2H2(g)+SO2(g)![]() S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
③2CO(g)+O2(g)==2CO2(g) △H3=-566.0 kJ·mol-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mo1-1
(1)写出液态硫(S)燃烧的热化学方程式_________________________________。
(2)一定压强下,反应①SO2的平衡转化率[α(SO2)]与投料比的比值![]() 温度(T)的关系如图所示。
温度(T)的关系如图所示。
则CO的平衡转化率:N___________M(填“>”、“<”、“=”,下同);逆反应速率:N___________P。

Ⅲ.电化学法
(1)原电池法:写出SO2、O2和稀H2SO4所构成的原电池的负极反应式___________。
(2)电解法:先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如下图所示。

①b为电源的___________(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是______________________。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫___________Kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钠的叙述中,正确的是
A.金属钠着火时,可立即用沾水的毛巾覆盖出B.钠在空气中长时间放置,最终变为NaOH
C.钠在空气中燃烧时,生成淡黄色固体D.取用一小块钠后,剩余的钠放到垃圾桶
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2CO(g) ![]() CO2(g)+C(s),T=980k时,△H-TΔS=O。当体系温度低于980k时.估计△H-T△S的正负符号为___,所以正反应____进行(填“自发”或“非自发”);当体系温度高于980k时.△H-T△S的正负符号为_______。 在冶金工业中,以C作为还原剂温度高于980k时的氧化物是以______为主,低于980k时以____为主。
CO2(g)+C(s),T=980k时,△H-TΔS=O。当体系温度低于980k时.估计△H-T△S的正负符号为___,所以正反应____进行(填“自发”或“非自发”);当体系温度高于980k时.△H-T△S的正负符号为_______。 在冶金工业中,以C作为还原剂温度高于980k时的氧化物是以______为主,低于980k时以____为主。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
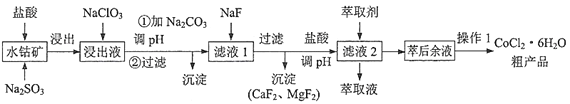
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
②部分阳离子开始沉淀和完全沉淀的pH见下表

③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出Co2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
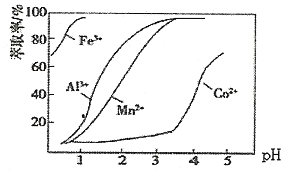
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2·6H2O常用减压烘干法烘干,原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。完成下列填空:



(1)A中加入NH4Cl与Ca(OH)2固体,写出加热时发生反应的化学方程式___;将制得氨气与氯化氢气体通入乙装置中,瓶内可以观察到的现象是____。
(2)丙为吸收尾气,乙装置的导管f连接的装置可以是____(填字母)。
a. b.
b. c.
c.
(3)向丙装置中加入浓氨水,通入空气,同时将加热的铂丝插入锥形瓶内,能使铂丝保持红热的原因是___。锥形瓶中不可能生成的物质是____(可多选)。
A.H2 B.NO2 C.HNO3 D.NH4NO3
(4)反应结束后锥形瓶内的溶液中含由H+、OH-、___、___离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是

A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种重要的化工原料。合成氨的反应的化学反应方程式为:N2(g)+3H2(g)2NH3(g)。完成下列填空:
(1)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为___反应(选填“吸热”、“放热”)。在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正___(选填“增大”、“减小”,下同),v逆___,平衡向___方向移动(选填“正反应”、“逆反应”、“不移动”)。
(2)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是___(填写编号)。

a.增大N2的浓度
b.扩大容器体积
c.加入催化剂
d.升高温度
改变条件后,平衡混合物中NH3的百分含量___(选填“增大”、“减小”、“不变”)。
(3)工业生产中选择铁触媒作催化剂,主要考虑的是____
a.使化学反应速率加快 b.这种催化剂对该反应催化剂效果更好
c.使原料利用率提高 d.其他物质对该反应不能起催化作用
(4)工业合成氨的简要流程图如下:

同学们发现:该流程设计得很巧妙,除了温度压强等因素外,至少有两处操作可以提高原料的利用率。一是___二是____。
(5)氨气的电子式____;氨气的水溶液滴入酚酞试液,溶液呈红色,用方程式解释溶液颜色变化____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com