
【题目】氨气是一种重要的化工原料。合成氨的反应的化学反应方程式为:N2(g)+3H2(g)2NH3(g)。完成下列填空:
(1)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为___反应(选填“吸热”、“放热”)。在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正___(选填“增大”、“减小”,下同),v逆___,平衡向___方向移动(选填“正反应”、“逆反应”、“不移动”)。
(2)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是___(填写编号)。

a.增大N2的浓度
b.扩大容器体积
c.加入催化剂
d.升高温度
改变条件后,平衡混合物中NH3的百分含量___(选填“增大”、“减小”、“不变”)。
(3)工业生产中选择铁触媒作催化剂,主要考虑的是____
a.使化学反应速率加快 b.这种催化剂对该反应催化剂效果更好
c.使原料利用率提高 d.其他物质对该反应不能起催化作用
(4)工业合成氨的简要流程图如下:

同学们发现:该流程设计得很巧妙,除了温度压强等因素外,至少有两处操作可以提高原料的利用率。一是___二是____。
(5)氨气的电子式____;氨气的水溶液滴入酚酞试液,溶液呈红色,用方程式解释溶液颜色变化____。
【答案】放热 增大 增大 正反应 c 不变 a 氢气与氮气可以循环使用 分离出液氨,平衡正向移动,提高了原料的转化率 ![]() NH3+H2ONH3H2ONH4++OH-
NH3+H2ONH3H2ONH4++OH-
【解析】
(1)在其他条件不变的情况下,降低温度平衡向放热反应方向移动,所以正反应为放热反应,在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,正逆反应速率都增大,平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,
故答案为:放热;增大;增大;正反应;
(2)t1时刻,正逆反应速率同等程度的增大,则改变的条件为催化剂,催化剂对化学平衡无影响,则平衡混合物中NH3的百分含量不变,
故答案为:c;不变;
(3)催化剂对化学平衡无影响,只改变反应的速率,所以工业生产中选择铁触媒作催化剂,主要考虑的是使化学反应速率加快,
答案选:a;
(4)可以通过氢气与氮气的循环使用;分离出液氨,来提高原料的利用率,
故答案为:氢气与氮气可以循环使用;分离出液氨,平衡正向移动,提高原料的利用率;
(5)氨气为共价化合物,电子式为: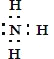 ;氨水中存在NH3+H2ONH3H2ONH4++OH,溶液呈弱碱性,所以氨气的水溶液滴入酚酞试液,溶液呈红色,
;氨水中存在NH3+H2ONH3H2ONH4++OH,溶液呈弱碱性,所以氨气的水溶液滴入酚酞试液,溶液呈红色,
故答案为: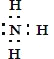 ;NH3+H2ONH3H2ONH4++OH。
;NH3+H2ONH3H2ONH4++OH。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A______;B_____;D______。
(2)C离子的电子式_______;E的离子结构示意图_______。
(3)写出电解D、E形成化合物的水溶液的化学反应方程式______。
(4)工业上将E的单质通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为______。漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质,该化学反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ·mol-1、计算下列中和反应放出的热量
(1)用20g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出___________kJ的热量
(2)用1mol醋酸稀溶液和足量的NaOH稀溶液反应,放出的热量 __________57.3kJ(填 “>”、“<”、或“=”)理由是______________________________________ 。
(3)1L0.1mol/L NaOH溶液分别与①醋酸溶液;②浓硫酸;③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位kJ)。则它们由大到小的顺序为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
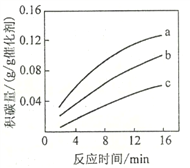
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述正确的是

A. lmol该有机物在镍催化下可消耗3molH2
B. 该有机物既能发生氧化反应又能发生还原反应
C. 该有机物的分子式为C12H18O2
D. 1mol该有机物能消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出基态Fe2+的核外电子排布式______________________;基态C1原子电子占据最高能级的电子云轮廓图为___________形。
(2)SO42-中心原子的轨道杂化类型为___________;NO3-的空间构型为___________。
(3)萤石晶胞结构如图I所示,则Ca2+的配位数是___________,萤石的化学式为 ___________。

(4)NiO氧化镍)晶胞结构如图Ⅱ所示,则每个Ni2+周围与其等距离的Ni2+有___________个;若Ni2+与最邻近O2-的核间距为a×10-8cm,则NiO晶体的密度为___________g·cm-3(列出计算式)(已知NiO的摩尔质量为74.7g·mol-1,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g) ![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是

A. 温度:T1< T2 B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:v(b)>v(a) D. 当m(总)/n(总)=30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是

A. 到平衡后,加入催化剂则C%增大
B. 化学方程式中n<e+f
C. 达到平衡后,若升温,平衡左移
D. 达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com