
科目: 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中一lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是

A. 常温下Ksp (CuS)的数量级为10-35
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有下列十种物质:①Cl2 ②钠 ③醋酸(CH3COOH) ④CO2 ⑤H2SO4 ⑥熔融KNO3 ⑦氨水 ⑧稀硝酸 ⑨Al2(SO4)3固体 ⑩NaHCO3,回答下列问题:
(1)属于电解质且能导电是____________(填序号)。
(2)写出①与水反应的化学方程式_____________________________。
(3)写出⑩溶于水时的电离方程式_____________________________。
Ⅱ.按要求回答下列问题:
(1)画 出 Cl-结构示意图 :____________。
(2)请用![]() 的形式,写出质子数为8,中子数为10的微粒符号_______。
的形式,写出质子数为8,中子数为10的微粒符号_______。
(3)某金属氯化物 MCl2 40.5g 中含有 0.6mol Cl-,则M的摩尔质量为____。
(4)相同温度和体积的 A 和 B 两容器,A容器中充满CO2,B容器中充满 O3,若密度相同,则二氧化碳和臭氧的物质的量之比为:_______。
(5)将24.5g H2SO4溶于水配成500mL溶液,其中SO42-的物质的量浓度为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________。SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是

A.t1℃时,在100 g水中放入60 g甲,其溶质的质量分数为37. 5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目: 来源: 题型:
【题目】物质A是基本有机化工原料,由A制备高分子树脂(M)和苯佐卡因(一种常用的局部麻醉剂)的合成路线(部分反应条件略去)如下所示:

已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46;B可以发生银镜反应。
②R-CHO+R’CH2CHO![]() 。
。
③苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位。
回答下列问题:
(1)C中含氧官能团的名称是____________,⑦的反应类型是___________,
A分子中最多有________个原子共平面, E的结构简式为_____________。
(2)写出反应⑥生成高分子树脂M的化学方程式_________________。
(3)在上述流程中“C→D”在M的合成过程中作用是_________________。
(4)满足下列条件的苯佐卡因的同分异构体共有______________(不考虑立体异构)种。
①苯环上只含有两个对位取代基,其中一个为—NH2;②含有酯基
(5)化合物 有较好的阻燃性,请参照流程及有关信息,写出以甲苯为主要原料制备该阻燃剂的合成路线流程图______________。
有较好的阻燃性,请参照流程及有关信息,写出以甲苯为主要原料制备该阻燃剂的合成路线流程图______________。
提示:①无机试剂任选;②合成路线流程图示例![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
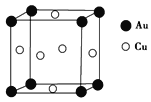
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0
C2H4(g)+4H2O(g) ΔH<0

(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=_________kJ·mol1。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的ΔH= 152 kJ·mol1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | O-H |
键能/(kJ·mol-1) | 803 | 436 | x | 414 | 463 |
(3)向1 L恒容密闭容器中通入1 mol CO2和n mol H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比X[ n(H2)/n(CO2 )]的关系如图所示。

①X1_________(填“>”、“<”或“=”,下同)X2;
②平衡常数KA_______KB,KB________KC;
③若B点时X=3,则平衡常数KB=_____________(代入数据列出算式即可);
④下列措施能同时满足增大反应速率和提高CO2转化率的是(__________)
a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来

(4)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则N极上的电极反应式为:_______________;该电解池中所发生的总反应的化学方程式为:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种短周期元素.它们的结构、性质等信息如下表所述:

请根据表中信息填写:
(1)A原子的核外电子排布式为________________。
(2)B元素在周期表中的位置是____;离子半径:B_____A(填“大于”或“小于”)。
(3)C原子的电子排布图是________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
(4)D原子的外围电子排布式为____________,D-的结构示意图是____________。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为________;B的最高价氧化物对应的水化物与D的氢化物的水溶液反应的化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)PH3的电子式为______________。
(2)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为:_____。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示:

①次磷酸属于____元酸,亚磷酸属于____元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= ____。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭 2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为_______________________________;
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是_______________________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:

①试剂x为_________填化学式);
②已知25℃时,H3 PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH____7(填“>”、“=”或“<”),通过计算说明理由:________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com