
科目: 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸普鲁卡因 ( 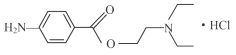 ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知将1mol SO2(g)氧化为1mol SO3(g)的 ΔH=-99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知将1mol SO2(g)氧化为1mol SO3(g)的 ΔH=-99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________。
(2)图中△H=____________kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________

查看答案和解析>>
科目: 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中发生下列反应 aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. a>c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、 锂。回答下列问题:

(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是___(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 该反应是否属于氧化还原反应?___(填 “是” 或 “否”); 滤渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为___。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为___。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是___。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
[TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com