
科目: 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________(至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以![]() 形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有室温下溶质浓度均为1×10﹣3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)一水合氨的电离方程式为_______,硫酸铵在水溶液中水解的离子方程式为_______。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________________________。
(3)在某温度下(Kw=1×10﹣12),将100 mL的①与100 mL的⑥溶液混合后(假设混合后溶液的体积为混合前两溶液的体积之和),溶液的pH=_________。
(4)若将等体积的②、③溶液加热至相同温度后,溶液的pH ②_______③(填“>” 、“=”或“<”)。
(5)若将③溶液和⑥溶液按体积比2:1混合后溶液呈酸性,则混合后溶液中c(CH3COO-)_______ c(CH3COOH)(填“>” 、“=”或“<”)
(6)室温时,若用①滴定⑤,适宜的指示剂为_____,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____(填数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,将3 mol A和2 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) ![]() 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)=_______;该温度下该反应的化学平衡常数表达式为__________。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)______α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号)__________。
a.生成C的速率与消耗B的速率相等 b.混合气体的密度不变
c.混合气体的相对平均分子质量不变 d.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的![]() H_____0(填“>”、“=”或“<”)。
H_____0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会__________(填“加快”、“减慢”或“不变”),化学平衡将_________(填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
(6)在恒温恒容密闭容器中进行上述反应,起始投料时各物质的浓度如下表:
A | B | C | |
投料I | 3.0 mol/L | 1.0 mol/L | 0 |
投料II | 2.0 mol/L | 1.0 mol/L | 2.0 mol/L |
按投料I进行反应,测得达到化学平衡状态时A的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”、“逆向”或“不移动)。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物H是一种重要的高分子化合物,其合成路线如下:
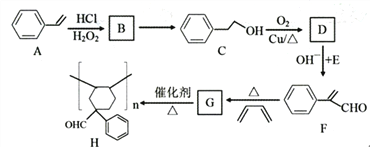
已知:
请回答下列问题:
(1)A的名称是_______________,C中含氧官能团名称是______________。
(2)写出反应类型:A→B______________,C→D__________________。
(3)B→C的反应试剂和反应条件是______________________。
(4)D+E→F的反应方程式是_________________。
(5)G的分子式是____________________。
(6)满足下列条件的F的同分异构体共有__________种(不考虑立体异构)。
a.苯环上有两个取代基,无其他环状结构;b.含碳碳三键,无-C≡COH结构。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、.CH3CHO、
、.CH3CHO、![]() -CHO合成多环化合物
-CHO合成多环化合物 的路线(无机试剂任选)______________
的路线(无机试剂任选)______________
查看答案和解析>>
科目: 来源: 题型:
【题目】I 、金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。己知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
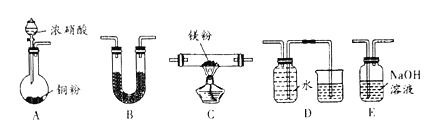
(1)实验中,装置依次连按的顺序为A _________(填字母序号);装置B 的作用是______;
(2)用来检验N2的实验装置为__________(填字母序号);
(3)设计实验证明:产物中存在Mg3N2 ____________;
Ⅱ、工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为__________。
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2 开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)___________;___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞显红色的溶液中:Na+、 Al3+、SO42-、Cl-
B. ![]() =1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
=1×1012的溶液中:NH4+、Na+、CO32-、SiO32-
C. c(Fe2+)=1 mol·L-1的溶液中:Mg2+、H+、MnO4-、SO42-
D. 无色透明溶液中:K+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】从海带中提取碘的工业生产过程如下:
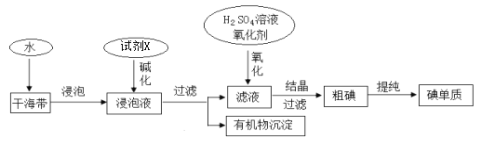
下列说法不正确的是
A.试剂X可以为NaOH溶液,其作用是使浸泡液中的可溶性有机物形成沉淀
B.氧化剂X可以用H2O2或适量的Cl2
C.干海带浸泡液中的碘离子可用淀粉溶液检验
D.氧化后的滤液在实验室也可采用四氯化碳萃取、分液、蒸馏的方法得到粗碘,蒸馏后得到的粗碘在蒸馏烧瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com