
科目: 来源: 题型:
【题目】(1)反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:

反应 CO2(g) + H2(g) ![]() CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) ![]() CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
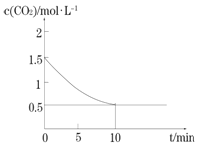
①该条件下反应的平衡常数为________________________________________;
②下列措施中能使平衡时c(CO)/c(CO2)增大的是______________________________________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________________________________(填字母)。
a.容器中压强不变 b.气体的密度不再改变 c.υ正(CO2)= υ逆(CO)
d.c(CO2)= c(CO) e.容器内气体总物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】400 ℃时,将一定量的SO2和 14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O2 ![]() 2SO3
2SO3
已知 2 min后,容器中剩余 2 mol SO2和12 mol O2。试计算:
(1)生成SO3的物质的量。______
(2)SO2的起始物质的量浓度。______
(3)2 min 内SO2和SO3的反应速率。______
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅥA族元素形成的化合物在实验室和工业生产上有着广泛的应用。回答下列问题:
(1)SCN-与Fe3+可形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使Fe3+的剩余价电子压缩配对,则每个配离子中Fe3+的单电子个数为_________个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式_____________。H2Se的酸性比H2S________(填“强”或“弱”)。H2O、H2S、H2Se沸点由高到低的顺序为__________________,原因是:___________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为_______,其VSEPR构型为_____________。
(4)已知S4O62-的结构为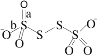 ,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
,其中S原子的杂化方式是_______________。键长a______b(填“>”、“<”或“=”)。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为M g/mol,则阳离子配位数为___________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
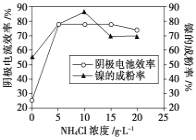
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题

(1)图中该反应是________________反应(填“吸热”或“放热”),反应热△H的表达式为_________________
(2)当反应达到平衡时,升高温度,A的转化率_________________(填“增大”“减小”或“不变”)。
(3)在反应体系中加入催化剂,E1和E2的变化是:E1________________________,E2________________(填“增大’“减小”或“不变”),化学_________________平衡移动(填“向左”、“向右”或“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃

图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:CH3COOH ![]() CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
(1)加入少量冰醋酸,平衡将_______________________,溶液中c(H+)将________________;
(2)加入一定量蒸馏水,平衡将__________________,溶液中c(H+)将__________;
(3)加入少量0.10mol/L盐酸,平衡将________________,溶液中c(H+)将_________________;
(4)加入20 mL 0.10mol/L的NaOH溶液,平衡将__________________,溶液中c(H+)将__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 1 L 1 mol/L葡萄糖溶液含有氧原子数为6NA
B. 氯气通入到含有1mol的FeBr2溶液中,当有NA个Br-被氧化时,共消耗标准状况下氯气22.4L
C. 标准状况下,2.24 L HF中所含质子数目为NA
D. 4.4 g由14CO2与14N2O组成的混合物中所含中子数为2.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com