
科目: 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是_____。BaO2的电子式为:__________。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
![]()
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为_____________。
②操作a是__________________。
③再生回收液的成分是______________________。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为____,该样品中H2O2的物质的量浓度为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(1)A装置是__________,B装置是_____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的_____(填“c极”或“d极”)区生成,其电极反应式为______________。
(3)A装置中通入O2的一极是____极,其电极反应式为_________________;通入SO2的一极是_____极,其电极反应式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
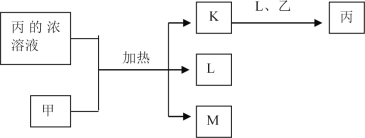
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目: 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
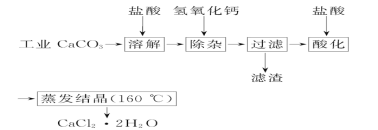
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3 是否沉淀完全的试验操作是_________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750 0 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.050 00 mol· L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需要溶液润洗的仪器有_______________________________。
②计算上述样品中CaCl2·2H2O的质量分数为________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因是________________________;______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
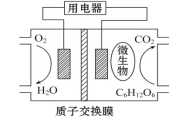
A. 该电池能够在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-====6CO2↑+24H+
C. 放电过程中,H+从正极区向负极区迁移
D. 在电池反应中,每消耗1 mol氧气,理论上能生成CO2气体22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列物质进行分类(均填序号)。互为同素异形体的是_______;互为同分异构体的是_______;互为同系物的是________.
①16O 和18O ②12C60与13C70③O2和O3 ④CH3CH2OH和CH3OCH3⑤正戊烷和异戊烷⑥ CH4和CH3CH2CH2CH3⑦ 和
和 ;⑧H2O与H2O2⑨金刚石与水晶
;⑧H2O与H2O2⑨金刚石与水晶
查看答案和解析>>
科目: 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
科目: 来源: 题型:
【题目】处理烟气中的SO2可以采用碱吸——电解法,其流程如左图;模拟过程Ⅱ如右图,下列推断正确的是


A. 膜1为阴离子交换膜,膜2为阳离子交换膜
B. 若用锌锰碱性电池为电源,a极与锌极相连
C. a极的电极反应式为2H2O一4e一=4H++O2↑
D. 若收集22.4L的P(标准状况下),则转移4mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
A. c(CH3COO-)>c(Na+) B. c(CH3COOH)>c(CH3COO-)
C. c(H+)<c(OH-) D. c(CH3COOH)+c(CH3COO-)=0.02 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com