
科目: 来源: 题型:
【题目】健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )

A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。

下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:

(1)甲、乙、丙三个装置中都发生的反应的化学方程式:__。
(2)和甲装置相比,乙装置的优点是
①__;
②__。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭止水夹__,再打开止水夹__,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该__。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用固体二氧化锰与浓盐酸在加热条件下制取氯气,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,已知浓盐酸易挥发。某学生设计如下图所示的实验装置,利用氯气与潮湿的熟石灰反应制取少量漂白粉(这是一个放热反应)。回答下列问题:
MnCl2+Cl2↑+2H2O,已知浓盐酸易挥发。某学生设计如下图所示的实验装置,利用氯气与潮湿的熟石灰反应制取少量漂白粉(这是一个放热反应)。回答下列问题:

(1)A装置为实验室制取氯气的装置,A装置中反应的离子方程式为__________________。
(2)漂白粉将在U形管中产生,其化学方程式是___________________________________。
(3)C装置的作用是____________________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与熟石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____________________。
②试判断另一个副反应_____________________________________(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
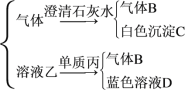
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的锂-氮二次电池,将可传递Li+的醚类作电解质,电池的总反应为![]()
![]()
![]() 。下列说法正确的是
。下列说法正确的是

A. 固氮时,锂电极发生还原反应
B. 脱氮时,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C. 固氮时,外电路中电子由钌复合电极流向锂电极
D. 脱氮时,Li+向钌复合电极迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com