
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )

A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
【答案】C
【解析】试题分析:断开K,I两个电极之间有电势差,II两个电极之间没有电势差,所以I是电源,II是电解池,K闭合后相当于I为II充电.K闭合,I中a为正极,b为负极,II中c为阴极,d为阳极,A、K闭合后相当于I为II充电.K闭合,I中a为正极,b为负极,II中c为阴极,d为阳极,K闭合时, d电极反应式:PbSO4+2H2O-2e-![]() PbO2+4H++S
PbO2+4H++S![]() ,A项正确;B、当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol ,B项正确;C、K闭合时, I中a为正极,b为负极,II中c为阴极,d为阳极,Ⅱ中S
,A项正确;B、当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol ,B项正确;C、K闭合时, I中a为正极,b为负极,II中c为阴极,d为阳极,Ⅱ中S![]() 向d电极迁移,C项错误;D、K闭合一段时间后断开,Ⅱ可单独作为原电池,d电极为正极,D项正确;答案选C。
向d电极迁移,C项错误;D、K闭合一段时间后断开,Ⅱ可单独作为原电池,d电极为正极,D项正确;答案选C。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )

A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. Pt为阴极,Cu为阳极
B. b极的电极反应式是2H++2e-=H2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
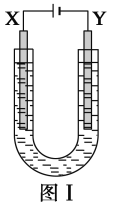
(1)X的电极名称是__________极,发生的电极反应式为______________,Y极的电极材料是____________,检验X极产物的方法是_______________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是________(填化学式),其形成原因是___________________,该沉淀在空气中放置,现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O![]() 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
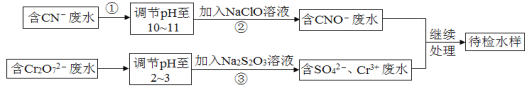
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______。
(2)步骤③的反应为![]() (未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______。
(4)在25℃下,将![]() 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com