
科目: 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_______________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图回答,下列说法不正确的是
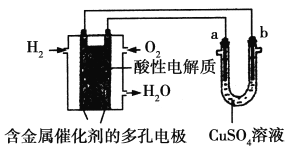
A. 此装置用于铁表面镀铜时,a为铁
B. 此装置用于电镀铜时,硫酸铜溶液的浓度不变
C. 燃料电池中正极反应为1/2O2+2e-+2H+===H2O
D. 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
查看答案和解析>>
科目: 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )
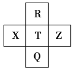
A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一块非常独特的手表,用 H~Mg 12 种元素分别表示 1:00~12:00,关于此表的下列说法中不正确的是( )
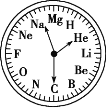
A.2:00 时的时针和 12:00 时的分针所指元素极难形成化合物
B.7:00 时,时针和分针所指元素可能形成相对分子质量为 100 的化合物
C.8:00 时,时针和分针所指元素形成的化合物属于碱性氧化物
D.3:00 时,时针所指元素的金属性比 11:00 时时针所指元素的金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是最常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化
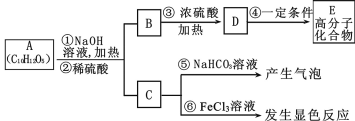
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
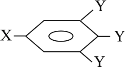 (其中:—X、—Y均为官能团)
(其中:—X、—Y均为官能团)
请回答下列问题:
(1)官能团-X的名称为____,反应③的类型为____;
(2)根据系统命名法,B的名称为____,高聚物E的链节为____;
(3)A的结构简式为____;
(4)反应⑤的化学方程式为____;
(5)C有多种同分异构体,其中符合下列要求的同分异构体共____种;
i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____(填序号)。
a 含有苯环 b 含有羰基 c 含有酚羟基
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________;
②Fe的基态原子共有______种不同能级的电子;
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_______;
②COCl2分子中σ键和π键的个数比为______,中心原子的杂化方式为_______;
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm,则熔点:NiO____(填“>”、“<”或“=”)FeO;
(4)铁的某种单质的晶胞为面心立方结构,原子的配位数为_______,若铁原子半径为a nm,则该单质的密度为_______g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com