
科目: 来源: 题型:
【题目】印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:
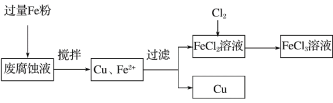
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是________(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为__________________________________。
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是__________________________________。
(4)按上述流程操作,需称取Fe粉的质量应不少于________ g(精确到0.1 g),需通入Cl2的体积不少于________ L(标况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学和环境保护、食品营养、材料应用等密切相关。
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是________(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是______(填元素符号)。
②下列物质中,具有抗菌消炎疗效的是________(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是__________,属于防腐剂的是________。

(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①水泥、玻璃及陶瓷都是传统的硅酸盐材料,生产水泥和玻璃都用到的原料是________;蓝色玻璃是在其中添加了氧化物________(写化学式);SiC是一种新型的陶瓷,工业上用石英砂与焦炭高温条件下生成SiC的同时的生成CO,该制备反应的化学方程式为_____________。
②钢铁制品在潮湿的空气中发生______(填“化学”或“电化学”)腐蚀是造成钢铁腐蚀的主要原因。硬铝(一种铝合金)是制造飞机和宇宙飞船的理想材料,和纯铝相比,硬铝强度________________(填“低”“高”或“无法确定”),具有较强的抗腐蚀能力。
③橡胶是制造轮胎的重要原料,天然橡胶通过________(填“硫化”“氧化”或“老化”)措施可增大其强度、弹性和化学稳定性等。
查看答案和解析>>
科目: 来源: 题型:
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置_________
(2)F元素的最高价氧化物对应的水化物的化学式为________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________(用离子符号表示)。
(4)写出化合物D2C2的电子式:________。
(5)E、F的简单离子的还原性大小顺序为:_________。
(6)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目: 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法不正确的是

A. B晶体中阴、阳离子个数比为1:2
B. 等体积等浓度的F溶液与D溶液中,阴离子总的物质的量F>D
C. 0.1molB与足量A或C完全反应转移电子数均为0.1NA
D. Y、Z分别形成的简单氢化物的稳定性前者弱于后者,是因为后者分子间存在氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下面列出了几组物质:A.金刚石与石墨;B.丙烯与环丙烷;C.氕与氘;D.甲烷与戊烷;E.液氨与氨水;F. ![]() 与
与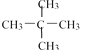 ;G.
;G. 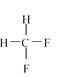 与
与 ,请将物质的合适组号填写在空格上。
,请将物质的合适组号填写在空格上。
①同位素_________
②同素异形体_________
③同系物_________
④同分异构体_________
⑤同一物质_________。
(2)下列物质中:①Ar ②MgBr2 ③Na2O2 ④H2SO4 ⑤CS2 ⑥NH4Br ⑦BaO ⑧RbOH。只存在共价键的是_________ (填序号,下同),只存在离子键的是_________,既存在离子键又存在极性共价键的是_________,既存在离子键又存在非极性共价键的是_________。
(3)异丁烷的一氯代物有_________种,新戊烷的一氯代物有_________种。C3H2Cl6的同分异构体有_________种,C5HCl11的同分异构体有_________种,乙烷和氯气在光照条件下发生取代反应所得产物最多有_________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 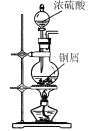 制备SO2
制备SO2
B. 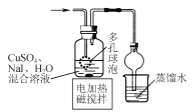 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 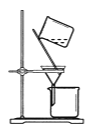 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 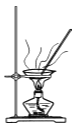 加热干燥湿的CuI固体
加热干燥湿的CuI固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com