
科目: 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
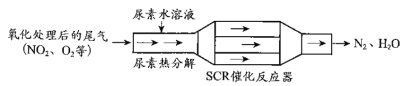
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
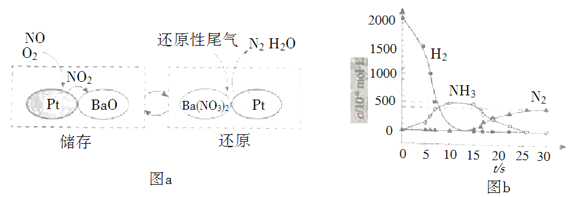
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: _______![]() □15NNO+□H2O_______
□15NNO+□H2O_______
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnSO4晶体的实验流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)用NaOH溶液处理废镀锌铁皮除溶解锌外,另一个作用是_______________。为缩短用NaOH溶液处理废镀锌铁皮的时间,可采取的措施是_____________(答两条)。
(2)加入适量H2O2溶液的主要作用是______________。溶液B中n(Fe2+):n(Fe3+)=______。
(3)在由溶液B制得Fe3O4胶体粒子的过程中,须缓慢滴加稀NaOH溶液并持续通入N2,持续通入N2的原因是_____________________。
(4)请补充完整下列由溶液A获得副产品ZnSO4晶体的实验步骤:
①向溶液A中通入CO2气体,得到Zn (OH)2沉淀;
②______________、洗涤得到沉淀;
③______________;
④将溶液加热浓缩、冷却结晶、过滤、洗涤、干燥即可得到产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ/mol P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ/mol P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。 下列叙述正确的是 ( )
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H
C. Cl-Cl键的键能为![]() kJ/mol
kJ/mol
D. P-P键的键能为![]() kJ/mol
kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(l)![]() =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·![]()
(4)![]() =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·![]()
下列关系式中正确的是( )
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g) △H,有关数据如下:

下列说法不正确的是( )
A.根据平衡常数随温度的变化关系,判断出△H<0
B.保持其他条件不变,SO2的平衡转化率a(727℃)<a(927℃)
C.增大压强、降低温度能提高SO2的转化率
D.SO3的稳定性随温度的升高而降低
查看答案和解析>>
科目: 来源: 题型:
【题目】现有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:从t2→t3的曲线变化是由哪种条件引起的

A. 增大X或Y的浓度 B. 增大压强
C. 增大Z的浓度 D. 升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀;
已知:向Ag+溶液中滴加氨水,先产生沉淀,继续滴加氨水,沉淀溶解。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是_____;所含阴离子相同的两种盐的化学式是________。
(2)D的化学式为____________,D溶液显碱性的原因是(用离子方程式表示)_____________。
(3)A和C的溶液反应的离子方程式是_______________;E和氨水反应的离子方程式是_______________。
(4)若要检验B中所含的阳离子,正确的实验方法是:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某物质X能发生如下转化,下列有关上述转化关系中物质及其反应的叙述不正确的是

A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com