
科目: 来源: 题型:
【题目】如图是某兴趣小组的探究性实验图示,有关说法合理的是( )
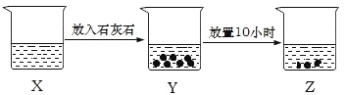
A. 若X中溶液为FeCl2溶液,则Z中最终可生成Fe(OH)2沉淀
B. 若X中溶液为新制的饱和氯水,则烧杯中液体的漂白性:X>Y>Z
C. 若X中溶液为NH4Cl溶液,则烧杯中液体的pH:X>Z
D. 若X中溶液为AlCl3溶液,可通过丁达尔现象证明 Z 中是否存在Al(OH)3胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
查看答案和解析>>
科目: 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)草酸与酸性高锰酸钾的反应的离子方程式为:__________________________________
(2)实验①②结论是___________________________________________________________。
(3)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(4)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为________。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(5)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(6))若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(7)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_____mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________________________________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
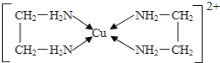
①Cu2+与乙二胺所形成的配离子中含有的化学键是_________________。
a.配位键 b.离子键 c.![]() 键 d.
键 d.![]() 键
键
②乙二胺分子中氮原子的杂化轨道类型为________________________,C、N、H三种元素的电负性由大到小顺序是________________________________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是_____________________________。(请结合原子的性质进行回答)
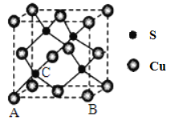
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为____________________
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为____________________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
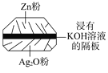
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
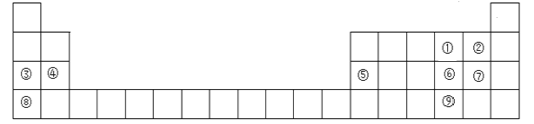
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
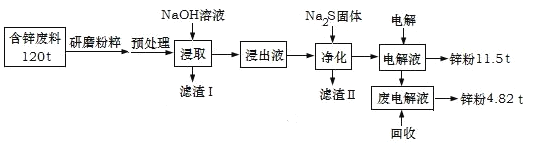
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图所示的转化关系,请回答下列问题:

(1)A中官能团的名称为___,B中官能团的电子式为__。
(2)在F的同系物中最简单的有机物的空间构型为__。
(3)写出与F互为同系物的含5个碳原子的有机物的所有同分异构体中,其中一氯代物种类最少的同分异构体的结构简式:___。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
②___,___;
④___,___。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
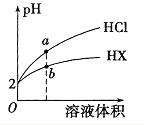
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com