
科目: 来源: 题型:
【题目】取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)求原混合液中Na2SO4的物质的量?__________________
(2)产生的气体在标准状况下的体积为多少?_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为___,在该反应中NaClO3和Na2SO3的物质的量之比为________。
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是________。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是________。
②已知Ksp(AgCl)=1.780×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3mol·L-1。试计算此时溶液中Cl-的浓度是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
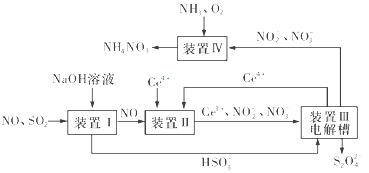
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量SO2通入下列溶液中,能出现白色浑浊的是( )。
①Ca(OH)2 ②BaCl2 ③NaAlO2 ④Na2SiO3 ⑤Ba(NO3)2 ⑥苯酚钠 ⑦Na2CO3
A. ①②④⑦ B. ②③⑥⑦ C. ④⑤⑥⑦ D. ③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)(提出猜想)小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O B.FeO SO3NH3H2O
C.FeO SO2NH3H2O D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定______________不成立(填序号)
(2)(药品验纯)甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)(实验探究)为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)(实验结论与反思)通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向 0.1mo1·L-1 的 H2SO4 溶液中滴入 0.1mo1·L-1 过量的 Ba(OH)2 溶液,溶液的导电能力发生变化,其电流强度 (I) 随加入 Ba(OH)2 溶液的体积 (V) 的变化曲线正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A. 滤液A中的阳离子为Fe3+、Fe2+、H+ B. 样品中Fe元素的质量为2.24g
C. 样品中CuO的质量为4.0g D. V=896
查看答案和解析>>
科目: 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
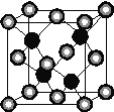
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com