
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H针对该反应回答下列问题:
SO2Cl2(g)△H针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g)△H1=﹣akJmol﹣1
2SOCl2(g)△H1=﹣akJmol﹣1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bkJmol﹣1
③a>b>0则△H=______kJmol﹣1(用含a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是______(填字母序号).
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号).(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(4)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=____.
②此温度下,该反应的K=___.
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是____.
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式____;已知25℃时,Ksp[AgCl]=1.8×10﹣10,Ksp[Ag2SO4]=1.4×10﹣5,则SO2Cl2于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断错误的是( )
A.NA个H+的质量为1 g
B.46g NO2和N2O4混合气体所含氧原子数目为2NA
C.在常温常压下,11.2L N2含有的分子数小于0.5NA
D.56g铁与足量的盐酸反应,转移的电子为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
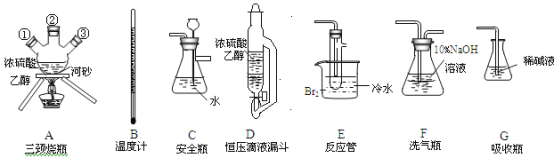
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32-
B. 用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 向NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+===2Mn2++5NO3-+3H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体原子个数之比为3∶2∶1
B.28 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目: 来源: 题型:
【题目】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去Mg2+的主要反应:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl
B. 试剂①一定不是Na2CO3溶液
C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D. 滤液加稀盐酸时只发生反应:HCl+NaOH=H2O+NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%。300 mL该溶液中氯离子的物质的量约等于( )
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列物质的化学性质,判断其应用错误的是
A. 酒精能使蛋白质变性,可用于杀菌消毒
B. CaO能与SO2反应,可作工业废气的脱硫剂
C. 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
D. 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com