
科目: 来源: 题型:
【题目】下列物质的用途利用了其还原性的是( )
A. 用葡萄糖制镜子或保温瓶胆
B. 用硫粉覆盖洒落在桌上的Hg
C. 用![]() 溶液制备木材防火剂
溶液制备木材防火剂
D. 用![]() 作为高效水处理剂
作为高效水处理剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A.摩尔是一个物理量,它表示含有一定数目粒子的集合体
B.摩尔是物质的量的单位,简称摩,符号为mol
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
D.1摩尔任何物质均含有6.02×1023个原子
查看答案和解析>>
科目: 来源: 题型:
【题目】测定![]() 溶液先升温再降温过程中的
溶液先升温再降温过程中的![]() ,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的
,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④产生的白色沉淀是![]()
C. ①→③的过程中,![]() 在降低
在降低
D. ①→③的过程中,温度与![]() 相比,前者对水解平衡的影响更大
相比,前者对水解平衡的影响更大
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
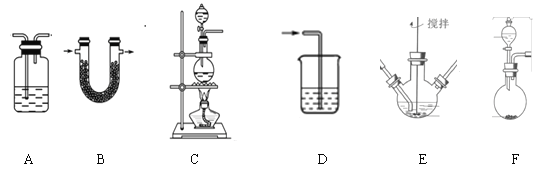
①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】电渗析法淡化海水的原理如图所示。已知海水中含![]() 等离子,电极为惰性电极。下列叙述正确的是
等离子,电极为惰性电极。下列叙述正确的是
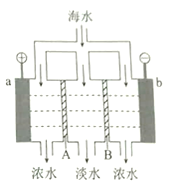
A. A是阳离子交换膜
B. 海水中阴离子移向b电极
C. a的电极反应为![]()
D. b极产生无色气体,出现白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL0.2mol/L的Na2SO4溶液和50mL0.2mol/L的Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为(设混合前后溶液的体积不变)( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】设一个12C原子的质量为a g,一个16O原子的质量为b g,阿伏加德罗常数为NA,则12C16O2的相对分子质量与以下哪些数值相同
①a+2b ②(a+2b)NA ③![]() ④
④![]()
A.①③B.②③C.①④D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
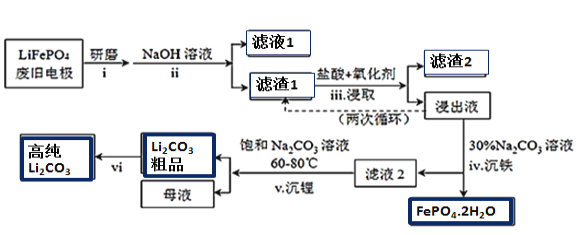
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠(Na2CO4)是一种很好的供氧剂,与稀盐酸发生反应的化学方程式为
2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。

(1)过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3,请写出Na2O2的电子式:__________________
(2)仪器B的名称为________,导管A的作用是_________________________________________
(3)该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭___和___并打开____(均填“K1”、“K2”或“K3”)
(4)其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为_________,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。
(5)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_____________(用含有x、y的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com