
科目: 来源: 题型:
【题目】I.在空气中泄漏的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用Na2SO3溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用Na2SO3溶液吸收SO2的离子方程式。________________
(2)钠原子核外有________种能量不同的电子。写出硫原子最外层电子的轨道表示式。____________
(3)H2O比H2S稳定,请用分子结构的知识简述其理由。______________________
II.一定温度下,固定容积的密闭容器中反生下列反应:2C(s)+2SO2(g) ![]() S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
S2(g)+2CO2(g),反应过程中,各物质浓度与时间的关系如图:
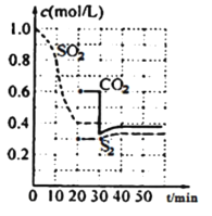
(4)该反应平衡常数表达式为K=________
(5)0~20min化学反应速率表示v(SO2)=________;建立平衡过程中,混合气体的密度________(选填“增大”、“减小”或“不变”)简述其原因。___________________________
(6)30min时改变外界条件,使v(正)________v(逆)(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:______________________。
(2)写出下列物质的电子式: D元素形成的单质__________;E2B________________;A、B、E形成的化合物__________;D、E形成的化合物__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体。

(1)写出有关的物质化学式。X: C: E: F:
(2)写出反应①的化学方程式_____________________________________
(3)写出反应②的离子方程式_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
(ii)I2(s)+H2(g)=2HI(g)-26.48kJ
下列判断正确的是
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U的氧化物是第三周期元素形成的常见两性氧化物;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是_______ (用元素符号表示,下同)。三种元素的第一电离能由大到小的顺序为__________。
(2)写出Y的价电子排布式____,W同周期的元素中,与W原子最外层电子数相等的元素还有________。
(3)根据等电子体原理,可知化合物XZ的结构式是________, YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________ (用化学式表示),原因是_____________。
(5)Y的氢化物易液化的原因是___________。
(6)XZ32-的立体构型是________,其中X原子的杂化轨道类型是________,互为等电子体的离子________。
(7)用氢键表示式写出Z的氢化物中存在的氢键________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应3Fe(S)+4H2O(g)=Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是_______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率________
③保持体积不变,充入N2使体系压强增大,其正反应速率________。
④保持压强不变,充入N2使容器的体积增大,其正反应速率_______。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
①A在5 min末的浓度是___________。② v(B) =___________。 ③ x=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:
①BF32﹣中心原子杂化方式________;CA3中心原子杂化方式________;
②FD42﹣微粒中的键角________; FD3分子的立体构型________。
(4)F元素两种氧化物对应的水化物酸性由强到弱为__________,原因__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com