
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D
【答案】B
【解析】
根据SO2、NO2、Cl2、HCl、CO2的有关化学性质可知,能使品红褪色的气体可能为SO2、NO2和Cl2,二氧化碳和二氧化硫都能使澄清石灰水变浑浊.
若打开活塞K,品红溶液褪色,X气体只可能是SO2、NO2或Cl2;关闭活塞K,
A、若X是NO2,通入饱和NaOH溶液中发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2被吸收,与品红溶液、澄清石灰水不反应,故A不符合;
B、若X气体为SO2,通入饱和NaHCO3溶液后发生反应:SO2+2NaHCO3═Na2SO3+2CO2↑+H2O,SO2被吸收而放出CO2,所以品红溶液无变化,而澄清石灰水变浑浊,故B符合;
C、若打开活塞K,品红溶液褪色,X气体只可能是SO2、NO2或Cl2,故C不符;
D、若X是Cl2,Cl2通入Na2SO3溶液后发生反应:Cl2+Na2SO3+H2O=Na2SO4+2HCl,无气体放出,所以品红溶液无变化,而澄清石灰水不变浑浊,故D不符;
故选B。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理有如下两种:①CH3OH(g)+H2O(g) = CO2(g)+3H2(g)ΔH = + 49.0 kJ·mol-1②CH3OH(g)+![]() O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示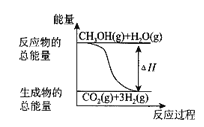
C.CH3OH转变成H2的过程一定要放出能量
D.根据②推知反应:CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g)![]() C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
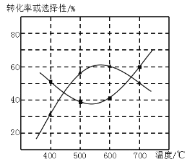
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应N2(g)+3H2(g)![]() 2NH3(g)达平衡的标志是( )
2NH3(g)达平衡的标志是( )
A.v正(N2)=v逆(N2)B.v正(N2)=3v正(H2)
C.v正(H2)=3v逆(NH3)D.N2、H2、NH3的体积比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3Fe(S)+4H2O(g)=Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是_______(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率________
③保持体积不变,充入N2使体系压强增大,其正反应速率________。
④保持压强不变,充入N2使容器的体积增大,其正反应速率_______。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
①A在5 min末的浓度是___________。② v(B) =___________。 ③ x=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇的说法正确的是( )
A. 通过加成反应可制取乙酸乙酯B. 可用淀粉水解产物来制取
C. 与乙醚互为同分异构体D. 乙醇不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备 1,2 —二溴乙烷的反应原理如下:①CH3CH2OH在浓硫酸170℃条件下生成CH2=CH2②CH2=CH2与Br2反应生成BrCH2CH2Br。现用少量溴和50gCH3CH2OH制备1,2 —二溴乙烷。回答下列问题:
(1)制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______。
A 加快反应速度 B 引发反应 C 防止乙醇挥发 D 减少副产物乙醚生成
(2)判断该制备反应已经结束的最简单方法是___________________。
(3)将 1,2 —二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(4)若产物中有少量副产物乙醚,可用____________的方法除去。
(5)若最终得到纯净1,2 —二溴乙烷94g,本实验的产率是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M(NO3)2热分解的化学方程式为:2M(NO3)2 ![]() 2MO+4NO2↑+O2↑。加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11200 mL的气体,那么M的摩尔质量是( )
2MO+4NO2↑+O2↑。加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11200 mL的气体,那么M的摩尔质量是( )
A.64 g·mol-1B.24 g·mol-1
C.65 g·mol-1D.40 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物
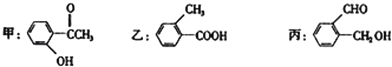
(1)请写出甲中含氧官能团的名称:________
(2)请判别上述哪些化合物互为同分异构体:_______
(3)甲、乙、丙三种物质中,遇FeCl3溶液显紫色的是_____(填“甲”“乙”或“丙”,下同),能与银氨溶液发生银镜反应的是_____,能与碳酸钠溶液反应放出CO2气体的是_____
(4)请按酸性由强至弱排列甲、乙、丙的顺序:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com