
【题目】M(NO3)2热分解的化学方程式为:2M(NO3)2 ![]() 2MO+4NO2↑+O2↑。加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11200 mL的气体,那么M的摩尔质量是( )
2MO+4NO2↑+O2↑。加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11200 mL的气体,那么M的摩尔质量是( )
A.64 g·mol-1B.24 g·mol-1
C.65 g·mol-1D.40 g·mol-1
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2和HNO3溶液反应生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验

(1)仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。

① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
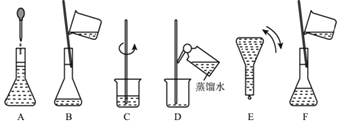
(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下PbSO4、PbCO3的溶度积常数分别为1.7×![]() 、7.4×
、7.4×![]() ,下列说法错误的是
,下列说法错误的是
A. PbSO4的饱和溶液中,c(Pb2+)约为1.3×![]()
![]()
B. 反应PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq)的平衡常数约为4.4×
PbCO3(s)+SO42-(aq)的平衡常数约为4.4×![]()
C. 向c(CO32-)=c(SO42-)的混合液中滴加Pb(NO3)2溶液,先得到PbCO3沉淀
D. PbCO3在水中的溶解度比在Pb(NO3)2溶液中的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com