
科目: 来源: 题型:
【题目】现有![]() 、
、![]() 、
、![]() 三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是
三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是![]()
A. 第一电离能:![]()
B. 简单离子半径:![]()
C. 电负性:![]()
D. 最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇分子中各化学键如图所示.下列关于乙醇在不同的反应中断裂化学键的说法错误的是
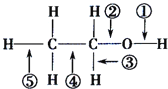
A. 与金属钠反应时,键①断裂
B. 在加热和Cu催化下与O2反应时,键①、③断裂
C. 与浓硫酸共热发生消去反应时,键②③断裂
D. 与乙酸、浓硫酸共热发生酯化反应时,键①断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
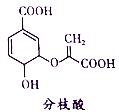
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 |
① | 制氧气 | H2O2→O2 |
② | 制氨气 | NH4Cl→NH3 |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是_________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是______,写出实验室制取该气体的化学方程式_______________________________
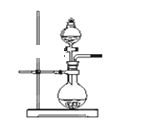
(2)若用上述装置制备NH3,则选择的试剂为____________________。
(3)制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为__________mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是_______________(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目: 来源: 题型:
【题目】将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体 | Y溶液 | 预测的现象 |
| |
① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
③ | Cl2 | AgNO3溶液 | 白色沉淀析出 | |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。完成下列问题:
(1)写出元素符号:W为________,X为_________,Y为__________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为___________。
(3)由Y、X、W组成的物质是由_________键和__________键组成的___________化合物。
查看答案和解析>>
科目: 来源: 题型:
【题目】将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.15 mol/(L·min)。试求:
(1)5 min后A的浓度__________________。
(2)B的平均反应速率为___________________。
(3)x的值为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中常涉及到一些重要的中学化学反应,以下有关叙述正确的是
A.工业上,用焦炭在高温下还原二氧化硅制得粗硅
B.通常将氯气通入到饱和石灰水中制得大量漂白粉
C.工业制硫酸将SO2氧化成SO3的条件一般选择高温、高压、催化剂
D.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来
查看答案和解析>>
科目: 来源: 题型:
【题目】解释下列事实的方程式正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓
B.SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32-
C.用石墨电极电解AlCl3溶液,阴极附近生成沉淀:2Al3++6H2O+6e- =2Al(OH)3↓+3H2↑
D.工业上制取硅:SiO2+C![]() Si+CO2
Si+CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:X(g)+2Y(g) ![]() 3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
A.升高反应温度,逆反应速率增大,正反应速率减小
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.1molX和2molY完全反应生成3mol的Z,放出akJ的热量
D.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com