
科目: 来源: 题型:
【题目】石油裂解可以得到乙烯、丙烯等小分子烃,它们是常见的有机化工原料。下图是以丙烯为原料合成有机物I的流程。
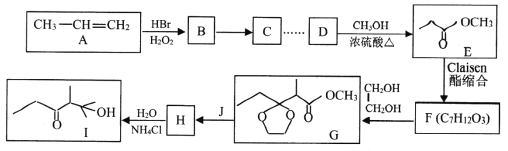
已知:
i.Claisen酯缩合: ![]()
ii. 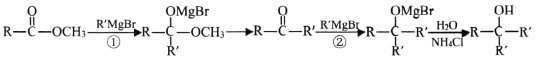 (②比①反应快)
(②比①反应快)
iii.![]() ,(R、R'代表烃基)
,(R、R'代表烃基)
回答下列问题:
(1)C的名称为_____________。Ⅰ中所含官能团的名称为______________________。
(2)B→C的反应类型是_______________。F的结构简式为_______________________。
(3)D→E的化学方程式为___________________________。
(4)由F到H过程中增加一步先生成G再生成H的目的是__________________________。
(5)化合物K与E互为同分异构体,已知1molK能与2mol金属钠反应,则K可能的链状稳定结构有_______种(两个一OH连在同一个碳上不稳定:一OH连在不饱和的双键碳、叁键碳不稳定),其中核磁共振氢谱有三组峰的结构简式为_______________。(任写一种)
(6)完成下列以苯乙烯为原料,制备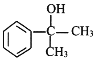 的合成路线(其他试剂任选) _____________。
的合成路线(其他试剂任选) _____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小祖的同学设计利用C2H2气体制取H2C2O42H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用如图装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是____________________________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为________________________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如图所示:

①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为___________________________________。
③从装置D中得到产品,还需经过__________________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol/L酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定时高锰酸钾标准溶液盛放在滴定管中_____________(填“酸式”或“碱式”)。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是______________ 。
③产品中H2C2O4·2H2O的质量分数为_________________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
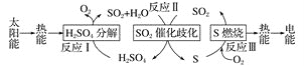
(1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___p1(填“>”或“<”),得出该结论的理由是____。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+_____===_____+____+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
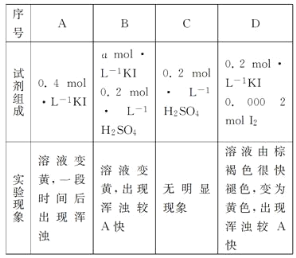
①B是A的对比实验,则a=_____。
②比较A、B、C,可得出的结论是_______。
③实验表明,SO2的歧化反应速率D>A。结合ⅰ、ⅱ反应速率解释原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
⑴①元素的名称:_______,⑧元素的符号:_______;
⑵在这些元素中,最活泼的金属元素的离子结构示意图是____,最活泼的非金属元素是____(填元素符号,下同),____是最不活泼的元素;
⑶这些元素的最高价氧化物对应水化物中,______(填化学式,下同)酸性最强,________碱性最强;能形成两性氢氧化物的元素是____(填元素符号);
⑷在⑤到的元素中,_______(填元素符号)原子半径最小;
⑸⑤和⑦两种元素最高价氧化物对应的水化物相互反应的离子方程式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示的装置收集以下7种气体:①H2 ②Cl2 ③O2 ④HCl ⑤NH3 ⑥NO ⑦NO2
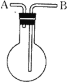
⑴若烧瓶是干燥的,则由B口进气,可收集的气体有___,若把装置颠倒,由A口进气,可收集的气体有____。
⑵若在烧瓶内充满水,可收集的气体有____,气体应由____口进入。
⑶若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有____,气体应由____口进入。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
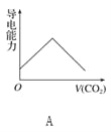
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
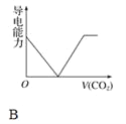

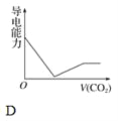
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是
(己知:CO32-+H2O![]() HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
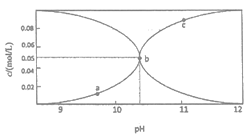
A. a点的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. b点横坐标数值大约为10.3
C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-)
D. 溶液中水的电离程度:a<b<c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com